
【题目】下列实验操作能达到实验目的是( )
选项 | 实验目的 | 实验操作 |
A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
A. A B. B C. C D. D
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是

A. 装置Ⅰ:先从①口进气收集满CO2,再从②口进气,可收集NO气体
B. 装置Ⅱ:可用该装置分离葡萄糖和淀粉的混合溶液
C. 装置Ⅲ:试管中盛有酸性高锰酸钾溶液可验证乙烯具有还原性
D. 装置Ⅳ:证明铁发生吸氧腐蚀时空气参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表: (请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置为_____________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为____;所含化学键类型______
(3)X+、 Y2-、M2-、R3+离子半径大小顺序为__________。
(4) 写出Z元素气态氢化物的形成过程___________。
(5)将YM2通入FeCl3溶液中的离子方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常教的值,N表示粒子数。下列叙述正确的是
A. 在标准状况下,78g苯的碳碳双键数目为3NA
B. 将1molCl2通入水中,则N(HClO)+N(C1-)+N(C1O-)=2NA
C. 将CO2通过Na2O2使其增重ag时,反应中转移电子数为aNA/44
D. 200g 30%的甲醛(HCHO)或醋酸溶液中含有的C原子总数都为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. H2、I2(g)混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:_________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是___________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:_________________________;
(4)该反应达到平衡时反应物X的转化率α等于__________________________________________ ;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是: 1___________________,2_______________________,3______________________。
1___________________,2_______________________,3______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低CO、NOx及碳氧化合物的排放。回答下列问题:
(1)引发光化学污染的气体是__________
(2)以NO为例,已知:
①H2(g)+1/2O2(g)=H2O(g) ΔH1
②2NO(g)+O2(g)=2NO2(g) ΔH2
③N2(g)+2O2(g)=2NO2(g) ΔH3
④2NO(g)+2H2(g)=2H2O(g)+N2(g) ΔH4=-664.14 kJ/mol
⑤2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH5=-746.48 kJ/mol
①②③④反应热效应之间的关系式为ΔH4=_______;有利于提高NO转化率的反应条件是_____;
在尾气处理过程中防止NO与H2反应生成NH3,提高其反应选择性的关键因素是________.
(3)研究表明不同负载钯量催化剂对汽车尾气处理结果如图所示,

根据图1和图2可知催化剂最佳负载钯的量为______;当负载钯的量过大时,三种尾气的转化率反面下降的原因是___________。
(4)向2L密闭容器中加入2molCO、4molH2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1molCO生成的同时有1molO-H键生成
(5)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为__________
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体中某些有机物及元素组成如下图。其中x、y代表化学元素,a、b、c、d代表不同的有机小分子,A、B、C、D、E代表不同的生物大分子,请据图分析回答:
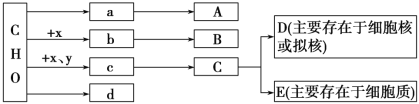
(1) 若A为动物特有的储能物质,则A表示的物质是________;若A为植物细胞壁的组成成分之一,则A表示的物质是________。
(2) 多个b可通过脱水缩合形成B,则x为______,连接两个b的化学键的结构简式是_____。
(3) 大肠杆菌的遗传物质是_______(用图中字母回答),它的细胞器由B和_______组成(用图中字母回答),其体内单体c有_______种。
(4) 在真核生物体内,A、B、D、E中可能具有催化作用的是________。
(5) 若d为胆固醇,其跨膜方式为________;其作用是构成细胞膜(或生物膜)的重要成分,在人体内还参与血液中脂质的运输。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com