
【题目】十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低CO、NOx及碳氧化合物的排放。回答下列问题:
(1)引发光化学污染的气体是__________
(2)以NO为例,已知:
①H2(g)+1/2O2(g)=H2O(g) ΔH1
②2NO(g)+O2(g)=2NO2(g) ΔH2
③N2(g)+2O2(g)=2NO2(g) ΔH3
④2NO(g)+2H2(g)=2H2O(g)+N2(g) ΔH4=-664.14 kJ/mol
⑤2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH5=-746.48 kJ/mol
①②③④反应热效应之间的关系式为ΔH4=_______;有利于提高NO转化率的反应条件是_____;
在尾气处理过程中防止NO与H2反应生成NH3,提高其反应选择性的关键因素是________.
(3)研究表明不同负载钯量催化剂对汽车尾气处理结果如图所示,

根据图1和图2可知催化剂最佳负载钯的量为______;当负载钯的量过大时,三种尾气的转化率反面下降的原因是___________。
(4)向2L密闭容器中加入2molCO、4molH2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1molCO生成的同时有1molO-H键生成
(5)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为__________
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL.
【答案】NOx和碳氢化合物(HC) 2ΔH1+ΔH2-ΔH3 降低温度、增大压强 找到合适的催化剂 2g/L 钯的负载量过大时在高温下可能使钯颗粒烧结,致使催化剂活性降低 de 2SO32-+4H++2e-=S2O42-+2H2O 1344
【解析】
试题(1)氮氧化合物、碳氢化合物是引发光化学污染的气体;(2)根据盖斯定律计算ΔH4;平衡正向移动有利于提高NO转化率;催化剂具有选择性;(3)转化率越高越好;(4)根据平衡标志分析;(5)①阴极得电子发生还原反应,SO32-失电子生成S2O42-;NO得电子生成NH4+,根据电子守恒计算NO在标准状况下的体积;
解析:引发光化学污染的气体是NOx和碳氢化合物;
(2)①H2(g)+1/2O2(g)=H2O(g) ΔH1 ②2NO(g)+O2(g)=2NO2(g) ΔH2 ③N2(g)+2O2(g)=2NO2(g) ΔH3 ;根据盖斯定律①![]() ②-③得2NO(g)+2H2(g)=2H2O(g)+N2(g) ΔH4= 2ΔH1+ΔH2-ΔH3;反应④⑤放热,降低温度平衡正向移动,增大压强平衡正向移动,有利于提高NO转化率的条件是降低温度、增大压强;催化剂具有选择性,所以防止NO与H2反应生成NH3,提高其反应选择性的关键因素是选择合适的催化剂;(3)根据图示,负载钯的量为2g/L,转化率最高;钯的负款量过大时在高温下可能使钯颗粒烧结,致使催化剂活性降低;(4)设CO 的变化量是xmol,则H2 的变化量是2xmol; a.根据化学方程式,CO、H2的体积比始终是(2-2x):(4-4x)=1:2,混合气体的平均相对分子质量是恒量,混合气体的平均相对分子质量保持不变不一定平衡,故a错误; b.CO的转化率是
②-③得2NO(g)+2H2(g)=2H2O(g)+N2(g) ΔH4= 2ΔH1+ΔH2-ΔH3;反应④⑤放热,降低温度平衡正向移动,增大压强平衡正向移动,有利于提高NO转化率的条件是降低温度、增大压强;催化剂具有选择性,所以防止NO与H2反应生成NH3,提高其反应选择性的关键因素是选择合适的催化剂;(3)根据图示,负载钯的量为2g/L,转化率最高;钯的负款量过大时在高温下可能使钯颗粒烧结,致使催化剂活性降低;(4)设CO 的变化量是xmol,则H2 的变化量是2xmol; a.根据化学方程式,CO、H2的体积比始终是(2-2x):(4-4x)=1:2,混合气体的平均相对分子质量是恒量,混合气体的平均相对分子质量保持不变不一定平衡,故a错误; b.CO的转化率是![]() ,H2的转化率
,H2的转化率![]() ,CO和H2的转化率始终相等,故B错误; c.CO的体积分数是
,CO和H2的转化率始终相等,故B错误; c.CO的体积分数是![]() ,H2的体积分数是
,H2的体积分数是![]() , CO和H2的体积分数始终保持不变 ,故c错误; d.根据
, CO和H2的体积分数始终保持不变 ,故c错误; d.根据![]() ,混合气体的密度保持不变,说明气体质量保持不变,一定达到平衡状态,故d正确; e.1molCO生成的同时有1molO-H键生成,说明
,混合气体的密度保持不变,说明气体质量保持不变,一定达到平衡状态,故d正确; e.1molCO生成的同时有1molO-H键生成,说明![]() ,一定达到平衡状态,故e正确;(5)①阴极SO32-失电子生成S2O42-,电极反应为2SO32-+4H++2e-=S2O42-+2H2O;设NO的体积为xL,NO得电子生成NH4+,根据电子守恒
,一定达到平衡状态,故e正确;(5)①阴极SO32-失电子生成S2O42-,电极反应为2SO32-+4H++2e-=S2O42-+2H2O;设NO的体积为xL,NO得电子生成NH4+,根据电子守恒![]() ,x=1.344L=1344mL。
,x=1.344L=1344mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是

A. MFe2O4表现了还原性
B. 若MFe2Ox 与H2发生反应的物质的量之比为2∶1,则x=3.5
C. 在该反应中每有1molNO2的废气被处理将转移电子数4NA个
D. SO2的还原性大于MFe2Ox
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
选项 | 实验目的 | 实验操作 |
A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅元素的单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
(1)硅在自然界中最主要的存在形式是_______和_______。
(2)有下列物体或设备:①水晶镜片 ②计算机芯片 ③玛瑙手镯 ④硅太阳能电池 ⑤石英光导纤维。(用序号填写)用到硅单质的是_________;所用材料主要为SiO2的是_________;
(3)写出工业上制取粗硅的化学反应方程式___________。其中,氧化剂为_____________,还原剂为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
H2(g)+![]() O2(g)===H2O(g);ΔH=-241.8 kJ/mol
O2(g)===H2O(g);ΔH=-241.8 kJ/mol
H2(g)+![]() O2(g)===H2O(l);ΔH=-285.8 kJ/mol
O2(g)===H2O(l);ΔH=-285.8 kJ/mol
则氢气的燃烧热为
A. 438.6 kJ/mol B. 241.8 kJ/mol C. 285.8 kJ/mol D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C分别是三种有机物的结构模型:
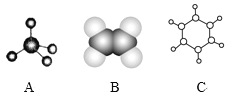
请回答下列问题:
(1)A、B两种模型分别是有机物____模型和___模型。
(2)A及其同系物的分子式符合通式____(用n表示)。当n=____时,烷烃开始出现同分异构体。
(3)A、B、C三种有机物中,所有原子均共面的是___(填名称)。结构简式为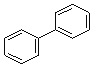 的有机物中,处于同一平面内的碳原子数至少为____。
的有机物中,处于同一平面内的碳原子数至少为____。
(4)有机物C不具有的结构或性质是_____(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液和溴水褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是__(填A、B、C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙66广泛用于制造机械、汽车、化学与电气装置的零件,亦可制成薄膜用作包装材料,其合成路线如图所示(中间产物E给出了两条合成路线)。
已知:R—Cl![]() R—CN
R—CN![]() R—CH2NH2
R—CH2NH2
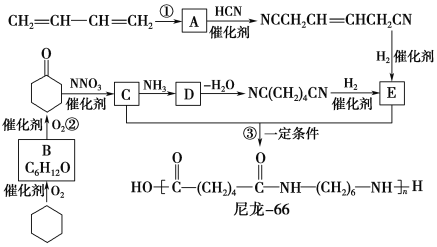
完成下列填空:
(1)写出反应类型:反应②________;反应③________。
(2)写出化合物D的结构简式:_____________________________________。
(3)写出一种与C互为同分异构体,且能发生银镜反应的化合物的结构简式:________________________。
(4)写出反应①的化学方程式:________________________________________________________________。
(5)下列化合物中能与E发生化学反应的是________。
a.NaOH B.Na2CO3
c.NaCl D.HCl
(6)用化学方程式表示化合物B的另一种制备方法(原料任选):_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com