
【题目】硅是无机非金属材料的主角,硅元素的单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用。试回答下列问题:
(1)硅在自然界中最主要的存在形式是_______和_______。
(2)有下列物体或设备:①水晶镜片 ②计算机芯片 ③玛瑙手镯 ④硅太阳能电池 ⑤石英光导纤维。(用序号填写)用到硅单质的是_________;所用材料主要为SiO2的是_________;
(3)写出工业上制取粗硅的化学反应方程式___________。其中,氧化剂为_____________,还原剂为_______________。
【答案】二氧化硅 硅酸盐 ②④ ①③⑤ SiO2+2C ![]() Si+2CO↑ SiO2 C
Si+2CO↑ SiO2 C
【解析】
(1)硅是一种亲氧元素,在自然界中最主要的存在形式是二氧化硅和硅酸盐;
(2)①水晶主要成分是SiO2;②计算机芯片主要是利用Si的半导体性质;③玛瑙主要成分是二氧化硅;④硅太阳能电池主要成分是单质硅;⑤石英光导纤维主要成分是二氧化硅;
(3)粗硅在工业上是以SiO2和焦炭在高温下反应制取,然后根据元素化合价的升降、结合氧化还原反应的规律,判断物质的作用。
(1)硅是一种亲氧元素,在自然界中最主要的存在形式是二氧化硅和硅酸盐;
(2)①水晶镜片主要成分是二氧化硅;
②计算机芯片主要成分是晶体硅;
③玛瑙手镯主要成分是二氧化硅;
④硅太阳能电池主要成分是晶体硅;
⑤石英光导纤维主要成分是二氧化硅;
因此上述四种物质中,用到硅单质的是②④;所用材料主要为SiO2的是①③⑤;
(3)在工业上以焦炭和二氧化硅为原料,在电炉中高温下反应制取粗硅,该化学反应方程式为:SiO2+2C![]() Si+2CO↑。在该反应中,Si元素的化合价降低,C元素的化合价升高,所以SiO2为氧化剂,C是还原剂。
Si+2CO↑。在该反应中,Si元素的化合价降低,C元素的化合价升高,所以SiO2为氧化剂,C是还原剂。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列产品或材料属于复合材料的是( )
①玻璃钢 ②采用碳纤维增强复合材料制的钓鱼竿 ③航天飞机机身 ④航天飞机隔热陶瓷瓦 ⑤纳米高分子复合材料
A. ①⑤ B. ①②③④⑤ C. ②⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表: (请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置为_____________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为____;所含化学键类型______
(3)X+、 Y2-、M2-、R3+离子半径大小顺序为__________。
(4) 写出Z元素气态氢化物的形成过程___________。
(5)将YM2通入FeCl3溶液中的离子方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. H2、I2(g)混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:_________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是___________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:_________________________;
(4)该反应达到平衡时反应物X的转化率α等于__________________________________________ ;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是: 1___________________,2_______________________,3______________________。
1___________________,2_______________________,3______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是( )
A.在一定条件下通入H2B.通入足量酸性高锰酸钾溶液中
C.通入足量溴水中D.分别进行燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出我国最近几年的PM2.5下降很多。有一方面归功于汽车尾气管中加装催化剂,它可有效降低CO、NOx及碳氧化合物的排放。回答下列问题:
(1)引发光化学污染的气体是__________
(2)以NO为例,已知:
①H2(g)+1/2O2(g)=H2O(g) ΔH1
②2NO(g)+O2(g)=2NO2(g) ΔH2
③N2(g)+2O2(g)=2NO2(g) ΔH3
④2NO(g)+2H2(g)=2H2O(g)+N2(g) ΔH4=-664.14 kJ/mol
⑤2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH5=-746.48 kJ/mol
①②③④反应热效应之间的关系式为ΔH4=_______;有利于提高NO转化率的反应条件是_____;
在尾气处理过程中防止NO与H2反应生成NH3,提高其反应选择性的关键因素是________.
(3)研究表明不同负载钯量催化剂对汽车尾气处理结果如图所示,

根据图1和图2可知催化剂最佳负载钯的量为______;当负载钯的量过大时,三种尾气的转化率反面下降的原因是___________。
(4)向2L密闭容器中加入2molCO、4molH2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
CH3OCH3(1)+H2O(1) ΔH=+71KJ/mol。下列叙述能说明此反应达到平衡状态的是_________(填序号)。
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1molCO生成的同时有1molO-H键生成
(5)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①阴极区的电极反应式为__________
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用系统命名法命名有机物![]() 和
和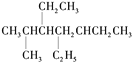 ,主链碳原子数均为7个
,主链碳原子数均为7个
B. 某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有4种
C. 碳原子数小于或等于8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有6种
D. 经测定C3H7OH和C6H12组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是78%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com