
����Ŀ��(1) 3.01��1023��OH�����ʵ���Ϊ________mol���������ӵ����ʵ���Ϊ_____mol�����е��ӵ����ʵ���Ϊ________mol����ЩOH��________g Na+���еĵ�������ͬ��
(2)��״���£�1.92gij��������Ϊ672mL����������Ħ������Ϊ______��
(3)��������SO2��SO3�����ʵ���֮��_______����ԭ�Ӹ�����Ϊ_________��
(4)11.1gCaCl2��������ˮ���500mL��Һ����Ũ��Ϊ_____ mol��L-1������ȡ��100 mL��Һ������Cl-�����ʵ���Ϊ_____mol��
���𰸡�0.5 4.5 5 11.5 64g/mol 5:4 5:6 0.2 0.04
��������
(1)OH-�����ʵ���=![]() =
=![]() =0.5mol��ÿ��OH-����9�����ӣ�0.5molOH-���е��������ʵ���=0.5mol��9=4.5mol����ÿ��OH-����10�����ӣ�0.5molOH-���еĵ������ʵ���=0.5mol��10=5mol����ÿ��Na+����10�����ӣ�����5mol���ӵ�Na+���ʵ���=
=0.5mol��ÿ��OH-����9�����ӣ�0.5molOH-���е��������ʵ���=0.5mol��9=4.5mol����ÿ��OH-����10�����ӣ�0.5molOH-���еĵ������ʵ���=0.5mol��10=5mol����ÿ��Na+����10�����ӣ�����5mol���ӵ�Na+���ʵ���=![]() =0.5mol��0.5molNa+����=0.5mol��23g/mol=11.5g��
=0.5mol��0.5molNa+����=0.5mol��23g/mol=11.5g��
(2)��״����672mL��������ʵ���=![]() =0.03mol��������Ħ������=
=0.03mol��������Ħ������=![]() =64g/mol��
=64g/mol��
(3) SO2Ħ������Ϊ64g/mol��SO3Ħ������Ϊ80g/mol����������SO2��SO3�����ʵ���֮��n(SO2):n(SO3)= ![]() =5:4��SO2��SO3��ԭ�Ӹ�����=(5��2):(4��3)=5:6��
=5:4��SO2��SO3��ԭ�Ӹ�����=(5��2):(4��3)=5:6��
(4)11.1gCaCl2�����ʵ���=![]() =0.1mol��������Һ�����ʵ���Ũ��c(CaCl2)=
=0.1mol��������Һ�����ʵ���Ũ��c(CaCl2)= ![]() =0.2mol/L����������Һ��ȡ��100mL��Һ��CaCl2��Ũ�Ȳ�����Ϊ0.2mol/L������c(Cl-)=0.2mol/L��2=0.4mol/L����100mL��Һ��Cl-�����ʵ���=0.4mol/L��0.1L=0.04mol��
=0.2mol/L����������Һ��ȡ��100mL��Һ��CaCl2��Ũ�Ȳ�����Ϊ0.2mol/L������c(Cl-)=0.2mol/L��2=0.4mol/L����100mL��Һ��Cl-�����ʵ���=0.4mol/L��0.1L=0.04mol��


 ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д� ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ����ˮ�ⷴӦ�����ܴ����������
A. H+ �� Cl- �� OH- �� Na+
B. Fe3+ ��NO3- ��S2-�� Na+
C. Ba2+ ��Al3+ �� K+ �� ��Al(OH)4 ��-
D. NH4+ ��CO32-�� K+ ��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����Ԫ��,���ǵĺ˵������������,�Ҷ�С��20������C��E�ǽ���Ԫ��;A��E��ͬ��,����ԭ�ӵ����������Ų�ʽΪns1��B��DҲ��ͬ��,����ԭ��������p�ܼ���������s�ܼ���������������Cԭ�ӵ���������������Dԭ�ӵ�������������һ�롣��ش���������:
(1)A��____,B��____,E��____��
(2)д��CԪ�ػ�̬ԭ�ӵĵ����Ų�ʽ: ________________ ��
(3)�õ����Ų�ͼ��ʾDԪ��ԭ�ӵļ۵��ӹ���:__________��
(4)Ԫ��B��D�ĵ縺�ԵĴ�С��ϵ��B____(�>����<����=��,��ͬ)D,E��C�ĵ�һ�����ܴ�С��ϵ��E____C��
(5)д��Ԫ��E��C������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽ
_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�������ճ��������й㷺Ӧ�á�
��1��д����Ԫ�������ڱ��е�λ��__________��
��2��д���ڿ�����Fe(OH)2ת��ΪFe(OH)3�Ļ�ѧ����ʽ____________��
��3���̷�(FeSO4��7H2O)�Dz�Ѫ����ԭ�ϣ��ױ��ʡ�
����FeSO4��Һ�Ƶ�FeSO4��7H2O�����еIJ�����______�����ˡ�ϴ�ӡ����
�������̷��Ƿ���ʵ��Լ���________��
��4�������̷��Ʊ���ԭ���۵Ĺ�ҵ��������:
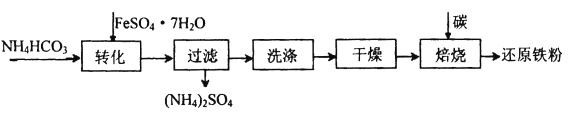
�����������Ҫ��Ϊ����ȥ����ˮ�ͽᾧˮ�������л�������FeCO3��nH2O�ڿ����б�����ΪFeOOH,�÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
��ȡ������FeCO3��Ʒ12.49g�����գ����յõ���ԭ����6.16g��������Ʒ������FeOOH������___________��
��5�����ʻ�������Ϊ�������û�ѧƽ���ƶ�ԭ�����롢�ᴿij������������(����һЩ����Ӧ������)����Ӧװ������ͼ��
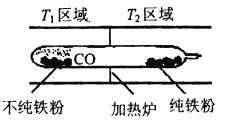
Fe(s)+5CO(g)![]() Fe(CO)5(g) ��H<0��T1___T2(����>������<������=��)��
Fe(CO)5(g) ��H<0��T1___T2(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NH3���ӿ���Cu2���γ���λ����������[Cu��NH3��4] 2��, ���ȥ����ͭ��Һ�����������ѡ�õ��Լ���
A. NaOH B. NH3 C. BaCl2 D. Cu(OH) 2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҩ�ǰѲݵijɷ�֮һM��������ɱ�����ã�M�Ľṹ��ͼ��ʾ��
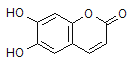
����������ȷ����
A. M����Է�������Ϊ180
B. 1mol M�������2mol Br2������Ӧ
C. M��������NaOH��Һ������Ӧʱ�������л�����Ļ�ѧʽΪC9H4O5Na4
D. 1mol M������NaHCO3��Ӧ������2molCO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʯ�ǵ��͵�ԭ�Ӿ��壬���й��ڽ��ʯ��˵���д������( )
A.�����в����ڶ�������������
B.̼ԭ�Ӽ��Թ��ۼ�����
C.��Ӳ����������֮һ
D.��ѧ�����ȶ�����ʹ�ڸ�����Ҳ����������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�һ�����жϻ�ѧƽ���ƶ�����
A. ������и���ֵ�Ũ�ȸı�
B. �����淴Ӧ���ʸı�
C. ������и���ֵİٷֺ����ı�
D. �����ϵ��ѹǿ�ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪MnO2Ϊ��ɫ������ˮ�Ĺ��壬ʵ������ȡ�����ķ�ӦΪ2KClO3![]() 2KCl��3O2������Ӧ���ʣ������л��ն������̵IJ���˳����ȷ����(����)
2KCl��3O2������Ӧ���ʣ������л��ն������̵IJ���˳����ȷ����(����)
A. �ܽ⡢���ˡ�������ϴ�� B. �ܽ⡢���ˡ�ϴ�ӡ�����
C. �ܽ⡢������ϴ�ӡ����� D. �ܽ⡢ϴ�ӡ����ˡ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com