
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| 4×4 |
| 2×2 |


科目:高中化学 来源: 题型:
| c(NO)?c(SO3) |
| c(NO2)?c(SO2) |
| A、该反应的焓变为正值 |
| B、恒温下减小压强,反应体系的颜色加深 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为NO2+SO?NO+SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu片、Cu片 |
| B、Cu片、Al片 |
| C、Al片、Al片 |
| D、Al片、Cu片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
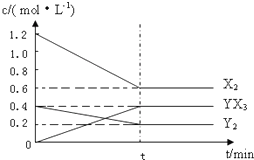 已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
2- 4 |
| 检验离子 | 所加试剂 | 实验现象 | 离子方程式 | ||
(1)CO
|
稀硝酸 | ||||
(2)SO
|
产生白色沉淀 | ||||
| (3)Cl- | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
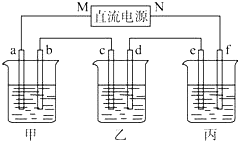 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com