
硒是制光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如下:
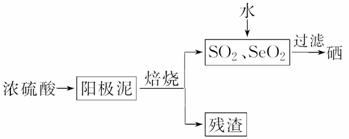
请回答下列问题:
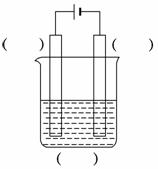
(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称。
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se和浓硫酸反应的化学方程式为________________________________________________________________________。
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3 mol·L-1,Ka2=5.0×10-8 mol·L-1),亚硒酸溶液与SO2反应制硒的离子方程式为_______________________________。
电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为________________________________________________________________________。
(4)上述硒的提取过程中存在的主要问题是_____________ _、__________________。
_、__________________。
解析 (1)电解精炼铜时粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液。(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物 为SO2,由此可得出化学方程式。(3)根据题中提示H2SeO3是弱酸,在离子方程式中应写化学式。电解亚硒酸溶液时,阳极发生氧化反应生成硒酸。
为SO2,由此可得出化学方程式。(3)根据题中提示H2SeO3是弱酸,在离子方程式中应写化学式。电解亚硒酸溶液时,阳极发生氧化反应生成硒酸。
答案 (1)左侧:粗铜 右侧:纯铜 电解液:硫酸铜溶液
(2)Se+2H2SO4(浓)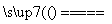 SeO2↑+2SO2↑+2H2O
SeO2↑+2SO2↑+2H2O
(3)H2SeO3+2SO2+H2O===Se+2SO +4H+ H2SeO3-2e-+H2O===SeO
+4H+ H2SeO3-2e-+H2O===SeO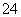 +4H+
+4H+
(4)浓硫酸的腐蚀性强 焙烧过程中产生大量有毒气体SO2,污染环境(其他合理答案亦可)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各实验,不可能成功的是( )
①蒸馏普通酒精制无水乙醇; ②苯与浓硫酸混合加热至60℃制硝基苯;
③用苯和溴水混合制溴苯; ④用裂化汽油从碘水中提取碘
A.只有①和④ B.只有②和③ C.只有①和③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学方程式中,不能用H++OH-=H2O表示的是( )
A . 2NaOH+H2SO4=Na2SO4+2H2O
B . Ba(OH)2+2HCl=BaCl2+2H2O
C. Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D . KOH+HCl=KCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
电解法处理酸性含铬废水(主要含有Cr2O )时,以铁板作阴、阳极,处理过程中存在反应Cr2O
)时,以铁板作阴、阳极,处理过程中存在反应Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
由CH3CH2CH2OH制备 ,所发生的化学反应至少有:①取代反应,②消去反应,③加聚反应,④酯化反应,⑤还原反应,⑥水解反应等当中的( )
,所发生的化学反应至少有:①取代反应,②消去反应,③加聚反应,④酯化反应,⑤还原反应,⑥水解反应等当中的( )
A.①④ B.②③
C.②③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某酯A,其分子式C6H12O2,已知

又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有
A.5种 B.4种
C.3种 D.2种
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.4 kJ·mol-1。起始反应时NO和CO各为4 mol,10秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.反应前5秒钟内,用NO表示的平均反应速率为0.1 mol·L-1·s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com