
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A. 氯气作水的杀菌消毒剂 B. 硅胶作袋装食品的干燥剂
C. 烧结粘土制陶瓷 D. 用含铁粉的透气小袋与食品一起密封包装是为了防止食品受潮
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学用语的表示正确的是( )
A.过氧化钠的电子式: ![]()
B.次氯酸分子的结构式:H﹣Cl﹣O
C.C60和石墨互为同位素
D.具有10个中子的氧原子: ![]() ?O
?O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(s)![]() Mg2+(aq)+2OH(aq)①
Mg2+(aq)+2OH(aq)①
![]() +H2O
+H2O![]() NH3·H2O+H+②
NH3·H2O+H+②
由于![]() 水解显酸性,H+与OH反应生成水,导致反应①的平衡右移,沉淀溶解;乙同学的解释是:
水解显酸性,H+与OH反应生成水,导致反应①的平衡右移,沉淀溶解;乙同学的解释是:
Mg(OH)2(s)![]() Mg2+(aq)+2OH(aq)③
Mg2+(aq)+2OH(aq)③
![]() +OH
+OH![]() NH3·H2O④
NH3·H2O④
由于NH4Cl电离出的![]() 与Mg(OH)2电离出的OH结合,生成了弱电解质NH3·H2O,导致反应③的平衡右移,Mg(OH)2沉淀溶解。
与Mg(OH)2电离出的OH结合,生成了弱电解质NH3·H2O,导致反应③的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是________(填字母)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由____________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理?________(填“甲”或“乙”);NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是
4NO+6H2O(g),下列叙述正确的是
A.若单位时间生成x mol NO的同时,消耗1.5x mol H2O,则反应达到平衡状态
B.达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4∶5∶4∶6
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.达到平衡时,5v正(O2)= 4v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.通式为CnH2n的不一定是烯烃,通式为CnH2n+2的一定是烷烃
B.烃按照有无芳香性可以分为脂环烃和芳香烃
C.乙烯中的碳碳双键的键能比乙烷中碳碳单键的键能小
D.石油裂解的目的是提高轻质油的产量和质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:ABCD .
(2)写出AB2的电子式为 .
(3)用电子式表示化合物C2D的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA
B.25℃时,pH=13的1.0 LBa(0H)2溶液中含有的OH-数目为0.2NA
C.常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA
D.1L1 mol·L-1FeCl3完全水解生成NA个胶体粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
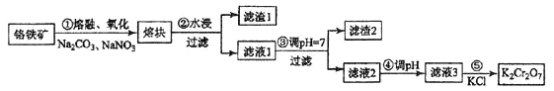
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com