
硝酸铜和铜粉混合物若干克,加热使其充分反应,反应前后固体物质质量不变,试计算原混合物中铜和硝酸铜的质量分数.
[硝酸铜受热分解的化学方程式为:![]()
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 16a |
| 22.4b |
| 16a |
| 22.4b |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
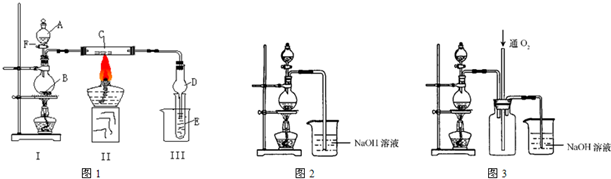
 图中,a是250mL的烧瓶,其中盛有标准状况下的空气(O2占
图中,a是250mL的烧瓶,其中盛有标准状况下的空气(O2占| 1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
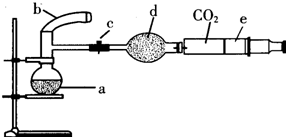
 实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.
实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.| 实验方法 | 有关化学方程式 | 实验用仪器(填序号) | 实验需直接测定的物理量(用文字说明) |
| (1) | H2SO4+CuO═CuSO4+H2O | ||
| (2) | 实验前坩埚与样品总质量(或坩埚质量)、实验后坩埚与CuO总质量 |
查看答案和解析>>
科目:高中化学 来源:2008-2009学年度泰安英雄山中学高三年级测试、化学试卷 题型:022
硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示)
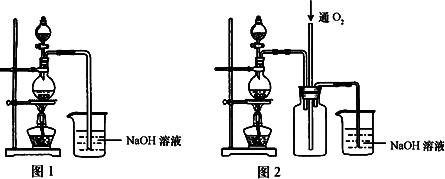
请回答相关问题:
(1)图1分液漏斗中装的液体是________________;
(2)本实验中若硝酸过量,造成的结果是________;
(3)图2是图1的改进装置,其优点是①________,②________;
(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向混合物中加入Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用〔已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4〕.
①方案1中用于灼烧铜粉的仪器名称是________;
②方案2中甲物质可以是________(填字母序号);
a.CuO
b.CuCO3
c.CaCO3
d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com