
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
B.CH4和P4都是正四面体结构,物质的量相同的CH4和P4的共价键数之比为![]()
C.标准状态下,1molH2和1molF2混合后,所含气体的体积为44.8L
D.常温常压下,0.5molFe和足量浓硝酸混合,转移电子数为1.5NA
科目:高中化学 来源: 题型:
【题目】已知单质铜与稀硝酸的反应为3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2(Cu的相对原子质量为64)。现把19.2 g Cu放入200 mL 5 mol·L-1硝酸中,充分反应,问:
(1)哪种物质过量?______
(2)参加反应的硝酸的物质的量为多少?______
(3)在标准状况下产生的气体的体积为多少?______
(4)生成水的分子数为多少?______
(5)若反应前后溶液的体积不变,则生成Cu(NO3)2的物质的量浓度为多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2019年诺贝尔化学奖颁给了三位在锂电池领域做出突出贡献的科学家。
①基态锂原子核外有________种不同空间运动状态的电子。
②![]() 状态的锂到
状态的锂到![]() 状态的锂所得的原子光谱是________光谱。
状态的锂所得的原子光谱是________光谱。
③锂和铍相比,锂的第Ⅱ电离能________(填“>”“<”或“=”)铍的第Ⅱ电离能。
(2)某锂离子电池的正极材料为![]() 。
。
①基态![]() 原子价层电子的电子排布图(轨道表达式)是________。
原子价层电子的电子排布图(轨道表达式)是________。
②磷元素是生物体不可缺少的元素之一,把一种填有![]() 的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。
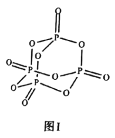
的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。![]() 的结构如图I所示,其中
的结构如图I所示,其中![]() 原子的杂化方式是________,
原子的杂化方式是________,![]() 是________(填“极性”或“非极性”)分子。
是________(填“极性”或“非极性”)分子。
③![]() 原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为________(用
原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为________(用![]() 表示磷原子的个数)。
表示磷原子的个数)。

(3)某锂电池负极材料晶体中![]() 嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
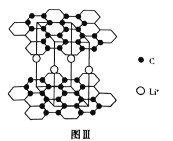
①石墨是一种导体,但石墨的导电性只能沿石墨平面的方向,原因是________。
②已知最近碳一碳原子间的距离是![]() ,则最近锂一锂离子间的距离是________
,则最近锂一锂离子间的距离是________![]() ;石墨层之间的距离是
;石墨层之间的距离是![]() (其中
(其中![]() ),
),![]() 表示阿伏加德罗常数的值,该晶体的密度是________
表示阿伏加德罗常数的值,该晶体的密度是________![]() (列出计算式即可)。
(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年,全国很多地区都曾出现严重的雾霾天气,汽车尾气、冬季取暖排放的CO2等都是形成雾霾的因素。请回答下列问题:
将不同物质的量的H2O(g)和CO分别通入容积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到3组数据如表所示:
CO2(g)+H2(g),得到3组数据如表所示:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
H2O | CO | CO | H2 | |||
1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
3 | 900 | a | b | c | d | t |
(1)实验1中0~5min内,以v(CO2)表示的化学反应速率为______,此温度下的化学平衡常数为______,温度升高时化学平衡常数会_______(填“增大”“减小”或“不变”)。
(2)若a=2,b=1,则达到平衡状态时实验2中H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
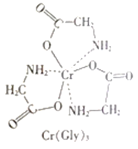
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
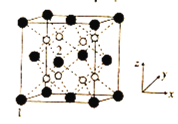
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com