
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����
A. ��֪2SO2(g)��O2(g)![]() 2SO3(g)Ϊ���ȷ�Ӧ����SO2������һ������SO3������
2SO3(g)Ϊ���ȷ�Ӧ����SO2������һ������SO3������
B. ��C(ʯī��s)=C(���ʯ��s)����H>0����ʯī�Ƚ��ʯ�ȶ�
C. ��֪NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l)����H=��57.4 kJ��mol��1����20.0 g NaOH������ϡ������ȫ�кͣ��ų�28.7 kJ������
D. ��֪2C(s)��2O2(g)=2CO2(g)����H1��2C(s)��O2(g)=2CO(g)����H2������H1>��H2
���𰸡�B
��������
A.��֪2SO2(g)+O2(g)![]() 2SO3(g)Ϊ���ȷ�Ӧ����2molSO2(g)��1molO2(g)������һ������2molSO3(g)����������SO2��������һ������SO3��������A����
2SO3(g)Ϊ���ȷ�Ӧ����2molSO2(g)��1molO2(g)������һ������2molSO3(g)����������SO2��������һ������SO3��������A����
B.��C(ʯī��s)=C(���ʯ��s)����H>0����ʯī���е������ȵ������Ľ��ʯ�������ͣ����ʺ��е�����Խ�ͣ����ʵ��ȶ��Ծ�Խǿ������ʯī�Ƚ��ʯ�ȶ���B��ȷ��
C.��֪NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l)����H=��57.4 kJ��mol��1��20.0 g NaOH�����ʵ�����0.5mol������NaOH��������ˮ��Ӧ�ų�����������20.0 g NaOH������ϡ������ȫ�кͣ��ų�����������28.7 kJ��C����
D.��������C��ȫȼ�շų����������ڲ���ȫȼ�շų������������ʷ�Ӧ�ų�������Խ�࣬��Ӧ�Ⱦ�ԽС��������H1<��H2��D����
�ʺ���ѡ����B��


 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ԭ��Ӧ�����������ֻ�����Ӧ���͵��ǣ� ��
A. ![]()
B. ![]()
C. ![]()
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��MgCl2��CaCl2��ɵĻ��Һ�У���������Ũ�ȴ�С��ͼ��ʾ���ش���������
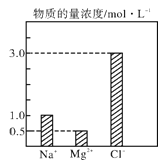
��1���û��Һ�У�NaCl�����ʵ���Ϊ_________mol��������MgCl2������Ϊ_______g��
��2���û��Һ��CaCl2�����ʵ���Ϊ___________mol�����û��Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Ca2�������ʵ���Ũ��Ϊ__________mol��L��1��
��3�����ϡ�ͺ����Һ�м������������ữ����������Һ���ɵõ�����________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���SO2ʹ��Һ��ɫ�Ļ�������̽����
I��SO2������Ʊ������ʳ�̽
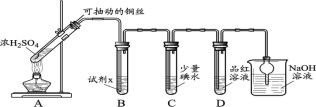
(1)װ��A�з�����Ӧ�Ļ�ѧ����ʽ____________��
(2)װ��B�е��Լ�x��____________��
(3)С��ͬѧ�۲쵽C��D����Һ����ɫ��ͨ������C��Һ����SO42-���ó�C����Һ��ɫ��ԭ����____________��
II��С��ͬѧͨ��ʵ�������D��Ʒ����Һ��ɫ����̽����
(4)̽��ʹƷ����ɫ����Ҫ��Ҫ�����ֱ�ȡ2 mL�Լ�a���μ�2��Ʒ����Һ��
װ�� | ��� | �Լ�a | ʵ������ |
| i | 0.1 mol/L SO2��Һ(pH=2) | ��ɫ��dz��֮����ȫ��ɫ |
ii | 0.1 mol/L NaHSO3��Һ(pH=5 ) | ��ɫ������dz��֮����ȫ��ɫ | |
iii | 0.1 mol/L Na2SO3��Һ( pH=10) | ��ɫ������ɫ | |
iv | pH=2H2SO4��Һ | ��ɫ�����Ա仯 | |
v | �Լ�a | ��ɫ�����Ա仯 |
��ʵ�� iii��Na2SO3��Һ�Լ��Ե�ԭ��_____________(��ϻ�ѧ�����������)��
�ڶԱ�ʵ��iii ��v�������ų��ڸ�ʵ��������OH-��Ʒ����ɫ��Ӱ�죬���Լ�a����
��__________��Һ��
�������ϣ�Ʒ����SO2ˮ��Һ��NaHSO3��Һ��Na2SO3��Һ��Ӧǰ���������£�
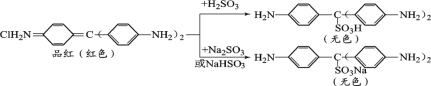
��ͨ������ʵ��̽����������ϣ�С��ͬѧ�ó����ۣ�һ��ʹƷ����Һ��ɫ����Ҫ����________������Ʒ����Һ����ɫ�仯��Ҫ��������е�________�ṹ�йء�
(5)��֤SO2ʹƷ����ɫ��Ӧ�Ŀ�����
�ټ�ͬѧ����ʵ��i��ɫ�����Һ�������̼�����ζ���壬��ɫ�ָ�������ѧƽ���ƶ��ǶȽ��ͺ�ɫ�ָ���ԭ��__________��
����ͬѧ��ʵ��i��ɫ�����Һ�е���Ba(OH)2��Һ��pH=10�����ɰ�ɫ��������Һ��졣д�����ɰ�ɫ���������ӷ���ʽ___________��
�۱�ͬѧ����SO2�Ļ�ԭ�ԣ����ñ��������Լ������������ʵ�飬֤ʵ��SO2ʹƷ����ɫ��Ӧ�Ŀ��棺���Լ�Y��__________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����͵��Ļ������ڹ�ũҵ�����������������ж��м���㷺����;����ش������뵪Ԫ���йص����⣺
��1���������ȣ��ṹʽΪCl-N=O�����л��ϳ��е���Ҫ�Լ�������Cl2��NO��ͨ�������·�Ӧ�Ƶã���Ӧ����ʽΪ![]() ��
��
��֪���ֻ�ѧ���ļ������������ʾ��
��ѧ�� |
|
|
|
|
���ܣ� | 243 | a | 607 | 630 |
��Cl2��NO��Ӧ����ClNO�Ĺ�����ת����4mol���ӣ������Ϸų�������Ϊ___kJ���������ֺ���ĸ��ʾ��
��2���¶�һ��ʱ����һ�����Ϊ1L���ܱ�������ͨ��2mol NO��1mol Cl2��10minʱClNO���ռ���������40%����Ӧ��ʼ��10min��NO��ƽ����Ӧ���ʣ�![]() =___
=___![]() ��
��
��3�����õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ�أ�װ����ͼ��ʾ��
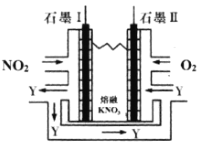
��ع���ʱ��NO2ת�����ɫ������Y��N2O5������ѭ��ʹ�ã���ʯī��Ϊ��Դ____����ʯī�����������ĵ缫��ӦʽΪ___��
��4��������ˮ����ˮ�����ɸ�Ӫ��������ʹ�ô�����ȥ����������NH4+��ʾ���������������ʡ�������������ȥ���������ӷ�Ӧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����SCN���ϼ�Ϊ��1�ۣ��ںܶ���±��ԭ�����ƣ���˳�Ϊ����±��������±��������±���ӻ�ԭ��ǿ��˳��ΪCl����Br����SCN����I������֪������I2��S�����з�Ӧ����ȷ����(����)
A. (SCN)2��2Br��=Br2��2SCN��
B. (SCN)2��H2S=2H����2SCN����S��
C. 4H����2SCN����MnO2![]() Mn2����(SCN)2����2H2O
Mn2����(SCN)2����2H2O
D. (SCN)2��2I��=2SCN����I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�����ȼ�ϡ��ϳɶ������ǽ����ԴΣ�����о�����֮һ��
(1)��CO2��H2���Ժϳɶ�����(CH3OCH3)��
��֪��CO(g)+2H2(g)=CH3OH(g) ��H1=��90.1 kJ��mol��1
CO(g)+H2O(g)=CO2(g)��H2(g) ��H2=��41.1 kJ��mol��1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ��H3=��24.5 kJ��mol��1
��Ӧ2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)��H=________��
(2)������(CH3OCH3)ȼ�ϵ�ؿ����������������ʡ����ö��������Խ���ȼ�ϵ�ص��200 mL����ʳ��ˮ(���Ե缫)��һ��ʱ��������ռ�������µ�����2.24 L(�������Һ�������)��
�ٶ�����ȼ�ϵ�ص�������ӦʽΪ��___________��������ӦʽΪ��_____________��
����д�����ʳ��ˮ�Ļ�ѧ����ʽ��____________________��
�۵�����Һ��c(OH��)=________�����������Ķ����ѵ�����Ϊ________(����һλС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mg-VOCl2�����һ�ֻ��������Ӵ��������Ͷ��ε�أ����װ��ʾ��ͼ���¡��ܷ�ӦΪMg��2VOCl2![]() MgCl2��2VOCl������˵���������
MgCl2��2VOCl������˵���������

A.����Mg���缫���ϱ�Li�İ�ȫ�Ը���
B.Ϊ�õ�س��ʱMg�缫Ӧ���Դ����������
C.�ŵ�ʱ������ӦΪVOCl2��e��= VOCl��Cl��
D.�ŵ������Cl��������������Һ����Mg�ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com