
【题目】在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题
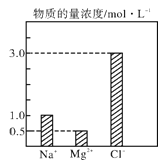
(1)该混合液中,NaCl的物质的量为_________mol,含溶质MgCl2的质量为_______g。
(2)该混合液中CaCl2的物质的量为___________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为__________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
【答案】0.2 9.5 0.1 0.1 0.6
【解析】
由题图可知,n(Na+)=0.2L×1.0mol/L=0.2mol,n(Mg2+)=0.2L×0.5mol/L= 0.1 mol,n(Cl-)=0.2L×3.0mol/L=0.6 mol,据此回答。
由题图可知,n(Na+)=0.2L×1.0mol/L=0.2mol,n(Mg2+)=0.2L×0.5mol/L= 0.1 mol,n(Cl-)=0.2L×3.0mol/L=0.6 mol,
(1)n(NaCl)=0.2 mol,n(MgCl2)=0.1mol,m(MgCl2)=0.1 mol×95 gmol-1=9.5g ;
(2)CaCl2提供的n(Cl-)=0.6mol-0.2 mol-0.1 mol×2=0.2 mol,则n(CaCl2)=0.1 mol,c(CaCl2)=![]() =0.1 molL-1;
=0.1 molL-1;
(3)根据上述推断,溶液中的Cl-的物质的量为0.6mol,根据Cl-+Ag+=AgCl↓,可得到沉淀0.6mol。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1) ![]() 中含有
中含有![]() __________
__________![]() 、
、![]() __________
__________![]() 。
。
(2)标准状况下,0.2 mol氨气(NH3)的体积是_________, 含氢原子数是_______。
Ⅱ.根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)氧化剂___________,还原剂___________;
(2)反应中转移电子数是_____________;
(3)得到1mol的N2需要被氧化的物质的质量为:_____________g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,镁在汽车、航空、航天、机械制造、军事等产业中应用迅猛发展。
(1)写出工业上冶炼金属镁的化学方程式______________________________________。
(2)某研究性小组探究以镁条、铝片为电极,稀氢氧化钠溶液为电解质溶液构成的原电池(如图所示),刚开始时发现电表指针向左偏转,镁条作负极;但随后很快指针向右偏转。
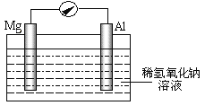
①开始阶段,镁条发生的电极反应式为_________,指出其反应类型为_________(填“氧化”或“还原”)。
②随后阶段,铝片发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸过程如图所示。NA为阿伏加德罗常数的值,下列说法正确的是
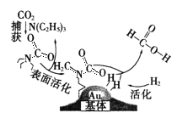
A.10.1gN(C2H5)3可溶于一定量盐酸形成盐,其中[N(C2H5)3H]+的数目为0.1NA
B.30g甲酸分子中,电子对数目为5 NA
C.在捕获过程中,若有22.4L CO2(标准状况)参与反应,则在反应过程中CO2分子只拆开了NA对电子对
D.该反应是氧化还原反应,每生成1mol甲酸,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
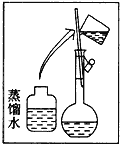
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。
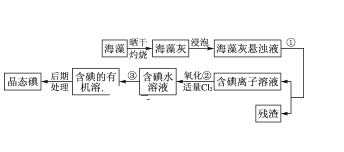
(1)指出提取碘的过程中有关的实验操作名称___、___。
(2)写出流程图中氧化②的离子反应议程式___。
(3)提取碘的过程中,可供选择的有机试剂是___。
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是___。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图中实验装置中的错误之处。
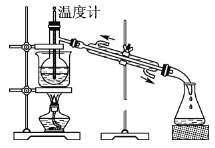
①____;
②____;
③____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。
(1)该同学应选择____ mL的容量瓶。
(2)其操作步骤如图所示,则图中操作应在下图中的____(填选项字母)之间。
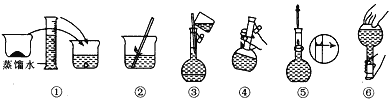
A.②与③ B.①与② C.④与⑤
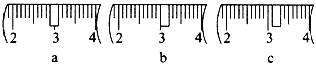
(3)该同学应称取NaOH固体_____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。

(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会_______③溶液未冷却就转移入容量瓶____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CaCO3质量分数为0.90的石灰石100 kg完全分解产生CO2________L(标准状况),石灰窑中该石灰石100 kg与焦炭焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的质量为__________g
(2)在25℃、101kPa的条件下,同质量的CH4和X气体的体积之比为15:8,则X的摩尔质量是_______________。
(3)两个相同体积的密闭容器X、Y,在25℃下,X中充入a gA气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,1个氧气分子体积为 ![]() cm3
cm3
B.铜电解精炼时,当阳极质量减少64 g时,电路中转移电子数为2NA
C.标准状况下22.4 L Cl2完全溶于水时,所得溶液中含氯微粒总数为2NA
D.NaCl晶体中Na+与最近Cl-的核间距离为a cm,则其晶体密度为 ![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2![]() N2O4平衡体系中充入He后,体系颜色变浅
N2O4平衡体系中充入He后,体系颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com