
【题目】某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。
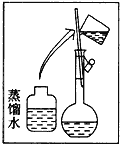
(1)该同学应选择____ mL的容量瓶。
(2)其操作步骤如图所示,则图中操作应在下图中的____(填选项字母)之间。
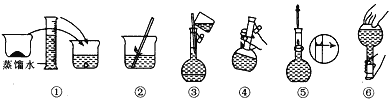
A.②与③ B.①与② C.④与⑤
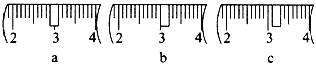
(3)该同学应称取NaOH固体_____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。

(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会_______③溶液未冷却就转移入容量瓶____________
【答案】500 C 10.0 cd c 偏小 无影响 偏大
【解析】
(1)实验室没有480mL规格的容量瓶,该同学应选择规格稍大的容量瓶。
(2)图中操作应是定容操作中往容量瓶内加水至液面离刻度线1~2cm处。
(3)该同学应称取NaOH固体0.5L×0.5mol/L×40g/mol=10.0g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,应选取所需砝码30g,游码位置3.1g。
(4)①转移完溶液后未洗涤玻璃棒和烧杯,溶质减少;
②容量瓶中原来有少量蒸馏水,溶质未变,溶液体积未变;
③溶液未冷却就转移入容量瓶,将导致溶液体积减小。
(1)实验室没有480mL规格的容量瓶,该同学应选择500mL的容量瓶,故答案为:500;
(2)图中操作应是定容操作中往容量瓶内加水至液面离刻度线1~2cm处,即选C,故答案为:C;
(3)该同学应称取NaOH固体0.5L×0.5mol/L×40g/mol=10.0g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,应选取所需砝码30g,游码位置3.1g,故答案为:10.0;cd;c;
(4)①转移完溶液后未洗涤玻璃棒和烧杯,溶质减少,溶质的物质的量浓度减小,即浓度偏小,故答案为:偏小;
②容量瓶中原来有少量蒸馏水,溶质未变,溶液体积未变,浓度不变,故答案为:无影响;
③溶液未冷却就转移入容量瓶,将导致溶液体积减小,浓度偏大,故答案为:偏大。


科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。根据下图转化关系完成下列各题:

(1)A的分子式是___________,C的名称是____________,F的结构简式是____________。
(2)D分子中的官能团名称是________________,请设计一个简单实验来验证D物质存在该官能团,其方法是_________________________________________________________。
(3)写出反应②、③的化学方程式并指出③的反应类型:
反应②:___________________________________;反应③:___________________________________,反应类型是___________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得较高反应速率,反应过程如图:
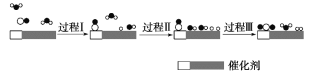
下列说法正确的是
A.若已知CO和H2的标准燃烧热,由此可推算出该反应的ΔH
B.过程Ⅰ、过程Ⅱ均为吸热过程,且吸收的热量相等
C.在该反应过程中,实际有两个H2O参与反应,断裂了三个氢氧键
D.使用催化剂降低了水煤气变换反应的ΔH,提高了反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题
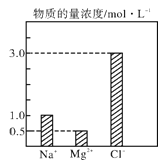
(1)该混合液中,NaCl的物质的量为_________mol,含溶质MgCl2的质量为_______g。
(2)该混合液中CaCl2的物质的量为___________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为__________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C(s) + H2O(g)![]() CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0
CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0
B. 25 ℃,向0.1 mol·L-1的NH4Cl溶液中加水,![]() 会增大
会增大
C. 用pH均为2的盐酸和甲酸中和等物质的量的NaOH溶液,盐酸消耗的体积多
D. 合成氨生产中将氨气液化分离,可加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物,研究表明该药物对新型冠状病毒2019-nCOV有较好抑制作用,以下是该药物主体氯喹的合成路线。
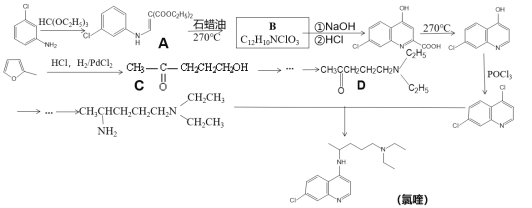
已知:①![]() 具有芳香性;
具有芳香性;
②R1-Cl+H2N-R2 → R1-NH-R2+HCl
请回答:
(1)下列说法不正确的是_________
A.氯喹具有弱碱性 B.氯喹的分子式为C18H24N3Cl
C.整个合成过程中包含了取代、加成反应 D.1molB最多可以消耗3molNaOH
(2)请写出A转化成B的化学方程式_________
(3)A转化成B的过程中还会生成一种双六元环副产物,其结构简式为_________
(4)请利用乙烯为原料将合成路线中C→D部分补充完整,用线路图表示出来(无机试剂任选)_________
(5)请写出满足下列条件的![]() 的同分异构体_________
的同分异构体_________
①1HNMR谱显示分子中只存在两种H;②分子内只存在一个环结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )

A. 该物质与水反应,属于氧化还原反应
B. Al2H6在空气中完全燃烧,产物为氧化铝和水
C. Al2H6分子中 氢为+1价,铝为﹣3价
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是373K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )
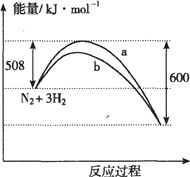
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 加入催化剂,该化学反应的反应热不变
C. a曲线是加入催化剂时的能量变化曲线
D. 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,则Q1=92
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com