
【题目】下列说法正确的是
A. C(s) + H2O(g)![]() CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0
CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0
B. 25 ℃,向0.1 mol·L-1的NH4Cl溶液中加水,![]() 会增大
会增大
C. 用pH均为2的盐酸和甲酸中和等物质的量的NaOH溶液,盐酸消耗的体积多
D. 合成氨生产中将氨气液化分离,可加快正反应速率,提高H2的转化率
【答案】AC
【解析】
A项、该反应在室温下不能自发进行,说明△H—T△S>0,由化学方程式可知△S>0,则该反应的△H>0,故A正确;
B项、NH4Cl溶液的水解平衡常数K=![]() ,平衡常数为温度函数,只与温度有关,向0.1mol·L-1的NH4Cl溶液中加水,平衡常数不变,故B错误;
,平衡常数为温度函数,只与温度有关,向0.1mol·L-1的NH4Cl溶液中加水,平衡常数不变,故B错误;
C项、甲酸为弱酸,pH均为2的盐酸和甲酸溶液,两种溶液中H+离子浓度相等,则甲酸浓度大与盐酸,设盐酸的浓度为c1,甲酸的浓度为c2,则有c1<c2,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有n=c1V1=c2V2,因c1<c2,所以V1>V2,消耗盐酸的体积更大,故C正确;
D项、合成氨生产过程中将NH3液化分离,氨气浓度减小,正、逆反应速率减小,故D错误;
故选AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( )
A. 该有机物分子的结构简式为CH3—CH3
B. 该有机物中碳、氢元素原子数目之比为1∶3
C. 该有机物分子中不可能含有![]() 双键
双键
D. 该有机物分子中可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的电子云轮廓图,试回答问题。


(1)s电子云轮廓图呈________形,每个s能级有________个原子轨道;p电子云轮廓图呈________状,每个p能级有________个原子轨道,其能量关系为____________(填“相同”或“不相同”)。
(2)元素X的原子最外层的电子排布式为nsnpn+1,原子中能量最高的是________电子;元素X的名称是____,它的氢化物的电子式是________。
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为________,原子的电子排布图为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子个数之比为__;氧原子个数之比为___。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92g该氧化物的体积为448mL,则该氧化物的摩尔质量为___,R的相对原子质量为__。
(3)常温下,在27.5g水中溶解12.5gCuSO4·5H2O,恰好达到饱和,该溶液的密度为1.21g/cm3,则该溶液中CuSO4的物质的量浓度约为__,从中取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol/L NaOH溶液以备使用。
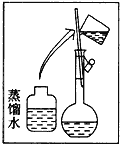
(1)该同学应选择____ mL的容量瓶。
(2)其操作步骤如图所示,则图中操作应在下图中的____(填选项字母)之间。
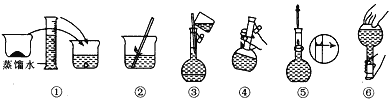
A.②与③ B.①与② C.④与⑤
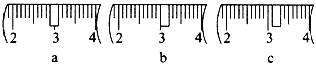
(3)该同学应称取NaOH固体_____g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小____(填字母),并在下图中选出能正确表示游码位置的选项____(填字母)。

(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会_______③溶液未冷却就转移入容量瓶____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+H2O(g)CO(g)+3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如右下图所示。
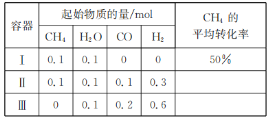
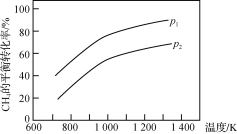
下列说法错误的是
A. 该反应的ΔH>0,图中压强P1>P2
B. 起始时,容器Ⅱ中v(CH4)正<v(CH4)逆
C. 达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ<2n(CO)Ⅰ
D. 达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比:pⅡ∶pⅢ=4∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取0.l molL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=9,试回答以下问题:
(1)混合溶液的pH=9的原因_____________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-) =______molL-1 ,0.1 molL-1NaOH 溶液中由水电离出的c(OH-) =______molL-1 。
(3)0.l molL-1 HA溶液与0.05 molL-1 NaOH溶液等体积混合后,pH=8,则
① 所得混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为:_________________。
② c(HA)+ c(A-)=_______ molL-1,c(HA)-c(A-)=_______molL-1。
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________7(填“>”、“<”或“=”)。
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____(填字母)。
A.NH4HCO3 B.NH4HSO4 C.NH4A D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改良Claus法利用天然气脱硫产生的H2S回收单质硫,首先将原料气通入反应炉并发生高温反应Ⅰ:2H2S(g) + 3O2(g) =2SO2(g) + 2H2O(g);反应后的混合气体通入串联的多个温度逐渐降低的转化器内进行反应Ⅱ:2H2S(g) + SO2(g)![]() 3S(l) + 2H2O(g)。下列说法正确的是
3S(l) + 2H2O(g)。下列说法正确的是
A.反应Ⅰ、Ⅱ消耗等量H2S时,转移电子数之比为2:1
B.根据工艺流程判断反应Ⅱ为吸热反应
C.通过串联多个转化器可提高硫的回收率
D.反应Ⅰ中消耗H2S的量占通入H2S总量的![]() 时,硫的回收率最高
时,硫的回收率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的化学方程式为3H2(g)+N2(g)![]() 2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
2NH3(g),下列说法能表示合成氨反应达到化学平衡状态的是
A. v逆(N2)=3v正( H2)
B. 三个H—H 键断裂的同时有六个N—H 键生成
C. NH3的百分含量保持不变
D. c(N2) : c(H2) : c(NH3)=1 : 3 : 2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com