
【题目】25℃时,取0.l molL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=9,试回答以下问题:
(1)混合溶液的pH=9的原因_____________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-) =______molL-1 ,0.1 molL-1NaOH 溶液中由水电离出的c(OH-) =______molL-1 。
(3)0.l molL-1 HA溶液与0.05 molL-1 NaOH溶液等体积混合后,pH=8,则
① 所得混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为:_________________。
② c(HA)+ c(A-)=_______ molL-1,c(HA)-c(A-)=_______molL-1。
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________7(填“>”、“<”或“=”)。
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____(填字母)。
A.NH4HCO3 B.NH4HSO4 C.NH4A D.NH4Cl
【答案】A- + H2O HA + OH- 10-5 10-13 c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+) 0.05 2×(10-6- 10-8) (或1.98×10-6) > A> C >D> B
【解析】
25℃时,0.l molL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合恰好完全反应生成NaA,溶液的pH=9说明NaA为强碱弱酸盐。
(1)NaA为强碱弱酸盐,A-在溶液中发生水解反应使溶液呈碱性,水解的离子方程式为A- + H2O![]() HA + OH-,故答案为:A- + H2O
HA + OH-,故答案为:A- + H2O![]() HA + OH-;
HA + OH-;
(2)NaA为强碱弱酸盐,A-在溶液中发生水解反应使溶液呈碱性,pH=9溶的液中c(OH-)=10-5mol/L,则溶液中由水电离出的c(OH-) =10-5mol/L;0.1 molL-1NaOH 溶液中c(OH-)=0.1mol/L,氢氧化钠是强碱,抑制水的电离,则0.1 molL-1NaOH 溶液中由水电离出的c(OH-=10-13mol/L,故答案为:10-5;10-13;
(3)①0.lmolL-1 HA溶液与0.05molL-1 NaOH溶液等体积混合得到等浓度的HA和NaA混合液,溶液pH=8说明HA的电离小于NaA的水解,则混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+);
②混合后溶液中c(Na+)=![]() mol/L =0.025mol/L,由溶液中存在物料守恒可得c(HA)+ c(A-)=2c(Na+)=2×0.025 mol/L=0.05mol/L;溶液中存在电荷守恒关系c(H+)+c(Na+)= c(OH-)+c(A-),与物料守恒关系整合可得c(HA)-c(A-)=2c(OH-)-2c(H+)= 2×(10-6- 10-8) mol/L,故答案为:0.05;2×(10-6- 10-8);
mol/L =0.025mol/L,由溶液中存在物料守恒可得c(HA)+ c(A-)=2c(Na+)=2×0.025 mol/L=0.05mol/L;溶液中存在电荷守恒关系c(H+)+c(Na+)= c(OH-)+c(A-),与物料守恒关系整合可得c(HA)-c(A-)=2c(OH-)-2c(H+)= 2×(10-6- 10-8) mol/L,故答案为:0.05;2×(10-6- 10-8);
(4)HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离常数相同,则(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,溶液的pH>7,故答案为:>;
(5)NH4HSO4是强酸酸式盐,在溶液中电离,溶液呈酸性;NH4Cl是强酸弱碱盐,铵根离子中水解,使溶液呈酸性,氯化铵溶液的pH值大于硫酸氢铵溶液;NH4A溶液中阴阳离子的水解程度相等,溶液呈中性,溶液的pH值大于氯化铵溶液;NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,则相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序A> C >D> B,故答案为:A> C >D> B。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 烯中C=C的键能是乙烷中C-C的键能的2倍
B. 氮气分子中含有1个s键和2个p键
C. N-O键的极性比C-O键的极性大
D. NH4+中4个N-H键的键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得较高反应速率,反应过程如图:
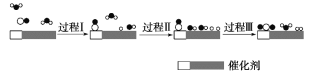
下列说法正确的是
A.若已知CO和H2的标准燃烧热,由此可推算出该反应的ΔH
B.过程Ⅰ、过程Ⅱ均为吸热过程,且吸收的热量相等
C.在该反应过程中,实际有两个H2O参与反应,断裂了三个氢氧键
D.使用催化剂降低了水煤气变换反应的ΔH,提高了反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. C(s) + H2O(g)![]() CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0
CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0
B. 25 ℃,向0.1 mol·L-1的NH4Cl溶液中加水,![]() 会增大
会增大
C. 用pH均为2的盐酸和甲酸中和等物质的量的NaOH溶液,盐酸消耗的体积多
D. 合成氨生产中将氨气液化分离,可加快正反应速率,提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物,研究表明该药物对新型冠状病毒2019-nCOV有较好抑制作用,以下是该药物主体氯喹的合成路线。
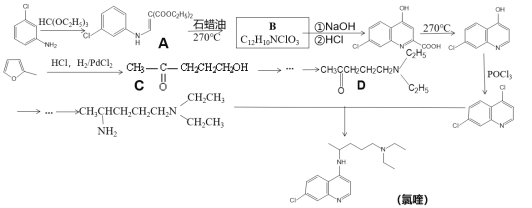
已知:①![]() 具有芳香性;
具有芳香性;
②R1-Cl+H2N-R2 → R1-NH-R2+HCl
请回答:
(1)下列说法不正确的是_________
A.氯喹具有弱碱性 B.氯喹的分子式为C18H24N3Cl
C.整个合成过程中包含了取代、加成反应 D.1molB最多可以消耗3molNaOH
(2)请写出A转化成B的化学方程式_________
(3)A转化成B的过程中还会生成一种双六元环副产物,其结构简式为_________
(4)请利用乙烯为原料将合成路线中C→D部分补充完整,用线路图表示出来(无机试剂任选)_________
(5)请写出满足下列条件的![]() 的同分异构体_________
的同分异构体_________
①1HNMR谱显示分子中只存在两种H;②分子内只存在一个环结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)2CO(g)=2C(s)+O2(g),该反应不能自发进行的原因是_____________________
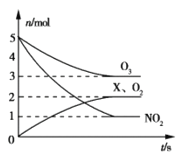
(2)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。一种脱硝反应中,各物质的物质的量随时间的变化如图所示,写出该反应的化学方程式__________________________。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。
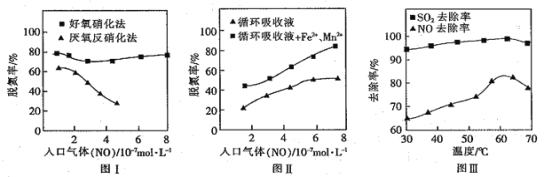
① 由图I知,当废气中的NO含量增加时,宜选用________法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为________。
③研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为________。
(4)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,涉及的相关反应如下:
反应①:NH3+HClO=NH2Cl+H2O
反应②:NH2Cl+HClO=NHCl2+H2O
反应③:2NHCl2+H2O=N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变![]() (即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量) 的影响如图4所示。
(即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量) 的影响如图4所示。
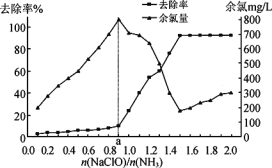
①反应中氨氮去除效果最佳的![]() 值约为_______。
值约为_______。
②a点之前氨氮去除率较低的原因为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )

A. 该物质与水反应,属于氧化还原反应
B. Al2H6在空气中完全燃烧,产物为氧化铝和水
C. Al2H6分子中 氢为+1价,铝为﹣3价
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白 [第(1)~(4)小题用元素符号填写]。
(1)第三周期原子半径最小的元素__________。
(2)第一电离能最大的元素__________。
(3)电负性最大的元素__________。
(4)第四周期中第一电离能最小的元素__________。
(5)含有8个质子,10个中子的原子的化学符号__________。
(6)最外层电子排布为4s24p1的原子的核电荷数为__________。
(7)周期表中最活泼的非金属元素原子的电子排布图为______________________________。
(8)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素的离子结构示意图__________。
(9)写出基态铜原子的电子排布式________________,位于__________区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) ![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g)
CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g) ![]() CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com