
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
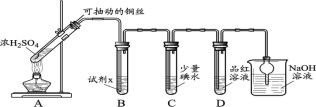
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
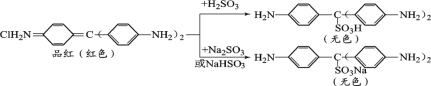
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑ +2H2O 饱和NaHSO3溶液 SO2具有还原性,与I2发生氧化还原反应,SO2+I2+2H2O=H2SO4+2HI,使碘水的黄色褪去。 SO32-在溶液发生水解,SO32-+ H2O
CuSO4+SO2↑ +2H2O 饱和NaHSO3溶液 SO2具有还原性,与I2发生氧化还原反应,SO2+I2+2H2O=H2SO4+2HI,使碘水的黄色褪去。 SO32-在溶液发生水解,SO32-+ H2O![]() HSO3-+OH-,SO32-结合H2O电离的H+,最终达到平衡时溶液中c(OH-)>c(H+),溶液呈碱性。 pH=10的NaOH溶液或pH=10的Na2CO3溶液 H2SO3、SO32-、HSO3- 双键或共轭或对醌式结构 SO2+H2O
HSO3-+OH-,SO32-结合H2O电离的H+,最终达到平衡时溶液中c(OH-)>c(H+),溶液呈碱性。 pH=10的NaOH溶液或pH=10的Na2CO3溶液 H2SO3、SO32-、HSO3- 双键或共轭或对醌式结构 SO2+H2O![]() H2SO3,加热使溶液中SO2逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,最终达到平衡时,溶液中品红浓度增大,溶液恢复红色。 SO2+2OH-+Ba2+=BaSO3↓+H2O 碘水
H2SO3,加热使溶液中SO2逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,最终达到平衡时,溶液中品红浓度增大,溶液恢复红色。 SO2+2OH-+Ba2+=BaSO3↓+H2O 碘水
【解析】
I.Cu与浓硫酸混合加热发生反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑ +2H2O,制取得到的SO2气体,经B装置中NaHSO3饱和溶液的缓冲作用,SO2具有还原性,在C中SO2与碘水会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI;SO2具有漂白性,将其通入D中的品红溶液,看到溶液红色褪去,SO2是大气污染物,通入NaOH溶液,发生反应:SO2+2NaOH=Na2SO3+H2O进行尾气处理。
CuSO4+SO2↑ +2H2O,制取得到的SO2气体,经B装置中NaHSO3饱和溶液的缓冲作用,SO2具有还原性,在C中SO2与碘水会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI;SO2具有漂白性,将其通入D中的品红溶液,看到溶液红色褪去,SO2是大气污染物,通入NaOH溶液,发生反应:SO2+2NaOH=Na2SO3+H2O进行尾气处理。
Ⅱ.(4)①利用盐的水解规律分析溶液显碱性的原因;
②选用溶液pH=10的NaOH或Na2CO3溶液进行对比;
③根据使品红溶液褪色的物质分析使品红溶液褪色的微粒;
(5)①加热实验i褪色后的溶液,产生刺激性气味气体,该气体为SO2,同时看到溶液红色恢复;
②SO2与Ba(OH)2发生反应产生BaSO3沉淀,同时看到溶液变红色;
③根据反应SO2+I2+2H2O=H2SO4+2HI分析SO2使品红褪色反应的可逆性。
(1)在装置A中Cu与浓硫酸共热,发生氧化还原反应,产生CuSO4、SO2、H2O,发生反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑ +2H2O;
CuSO4+SO2↑ +2H2O;
(2)B装置中溶液可以缓冲气流,同时不能溶解SO2气体,可根据H2SO3是二元弱酸,在溶液中存在电离平衡,则B中x溶液为饱和NaHSO3溶液;
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,这是由于I2具有氧化性,而SO2具有还原性,在溶液中二者会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI,反应产生的H2SO4、HI的水溶液均无色,使C中溶液褪色;
(4)①Na2SO3是强碱弱酸盐,在溶液中SO32-会发生水解反应:SO32-+H2O![]() HSO3-+OH-,SO32-结合H2O电离的H+,当最终达到平衡时,溶液中c(OH-)>c(H+),因此溶液呈碱性;
HSO3-+OH-,SO32-结合H2O电离的H+,当最终达到平衡时,溶液中c(OH-)>c(H+),因此溶液呈碱性;
②对比实验iii和v,可以排除在该实验条件下OH-对品红褪色的影响,实验iii为pH=10的Na2SO3溶液,则试剂a可能为pH=10的NaOH溶液或pH=10的Na2CO3溶液;
③根据实验可知,向红色的品红溶液中加入Na2SO3、NaHSO3,会看到溶液红色褪去,说明使品红溶液褪色的主要微粒是H2SO3、SO32-、HSO3-;根据反应前后溶液颜色变化,结合物质分子结构可知:品红溶液中颜色变化主要与其分子中的双键或共轭或对醌式结构有关;
(5)①向品红溶液中通入SO2气体,溶液红色褪去,将褪色后的溶液加热,产生刺激性气味气体,红色恢复,说明SO2气体溶于水发生反应:SO2+H2O![]() H2SO3,加热时溶液中SO2气体逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,品红浓度增大,溶液又恢复红色;
H2SO3,加热时溶液中SO2气体逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,品红浓度增大,溶液又恢复红色;
②向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,发生反应:SO2+2OH-+Ba2+=BaSO3↓+H2O,生成白色沉淀,由于SO2浓度降低,SO2与品红反应逆向移动,品红浓度增大,使溶液又恢复了变红;
③由于SO2具有还原性,与碘水会发生氧化还原反应:SO2+I2+2H2O=H2SO4+2HI,使溶液中SO2浓度降低,SO2与品红反应逆向移动,导致品红浓度增大,最终使溶液又恢复了变红。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
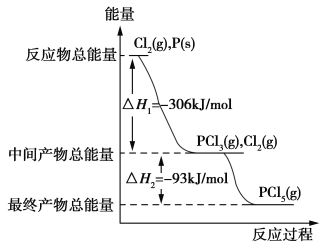
根据图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式为_____________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式为_____________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4________(填“>”“<”或“=”)ΔH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核酸检测对防疫新冠肺炎意义重大。下图1是脱氧核糖核酸(DNA)的结构片段,它的碱基中胞嘧啶的结构如图2,下列说法正确的是
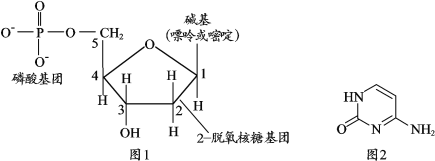
A.脱氧核糖核酸中含有的化学键都是不同原子形成的极性共价键
B.2-脱氧核糖(C5H10O4)与葡萄糖属于同系物,都能发生银镜反应
C.胞嘧啶分子式为C4H5N3O,含有的官能团是氨基和肽键
D.脱氧核糖核酸由磷酸、2-脱氧核糖和碱基通过一定方式结合而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A.Na2CO3比NaHCO3热稳定性强
B.相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
C.相同温度下,Na2CO3的溶解度小于NaHCO3
D.物质的量浓度相同时,Na2CO3溶液的pH比NaHCO3溶液的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应___(只需标出电子得失的方向和数目)。
(2)上述反应中氧化剂是___,氧化产物是___。
(3)反应中还原剂与氧化剂的物质的量之比为___。
(4)若反应中转移了0.3mol电子,则生成标准状况下NO的体积为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量各为0.1mol钠、镁、铝单质,分别投入足量盐酸溶液中,生成相同条件下氢气的体积比为___。
(2)物质的量各为0.2mol的铝、铁、锌,分别与100ml1mol/L的硫酸溶液反应,生成相同条件下氢气的体积比为___。
(3)等质量的两份铝分别与足量的盐酸溶液和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 分别用B、C、D表示反应的速率,其比值是3∶1∶2
C. 在2 min末时的反应速率,用产物C来表示是0.2mol·L-1·min-1
D. 在这2 min内用B和C表示的反应速率的值都是不同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com