
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应___(只需标出电子得失的方向和数目)。
(2)上述反应中氧化剂是___,氧化产物是___。
(3)反应中还原剂与氧化剂的物质的量之比为___。
(4)若反应中转移了0.3mol电子,则生成标准状况下NO的体积为___。
【答案】 HNO3 Cu(NO3)2 3:2 2.24L
HNO3 Cu(NO3)2 3:2 2.24L
【解析】
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中铜元素化合价升高,硝酸中氮元素化合价降低,每消耗3mol铜,失去6mol电子,以此来解答。
(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为 ;
;
(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物,答案为:HNO3,Cu(NO3)2;
(3)反应中HNO3部分起氧化剂的作用部分起酸性的作用,故还原剂Cu与氧化剂HNO3的物质的量之比为3:2;
(4)根据化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,当生成2molNO时,转移的电子为6mol,若反应中转移了0.3mol电子,标准状况下,生成NO的体积为![]() 22.4L/mol= 2.24L。
22.4L/mol= 2.24L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,某绝热恒容密闭容器中的反应2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
A. N2O5,NO2,O2分子个数比为 2∶4∶1B. 混合气体的密度不再改变
C. 体系温度不再改变D. N2O5已全部转化为NO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。
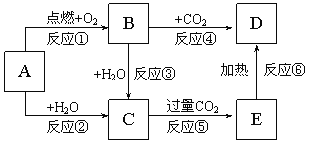
请填写下列空白:
(1)写出化学式:A_______、B______、 C_______。
(2)以上反应中属于氧化还原反应的有_______。(填写编号)
(3)写出A→C反应的离子方程式_______;E→D的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题
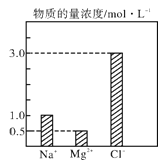
(1)该混合液中,NaCl的物质的量为_________mol,含溶质MgCl2的质量为_______g。
(2)该混合液中CaCl2的物质的量为___________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为__________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1molL﹣1的盐酸的体积为( )
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
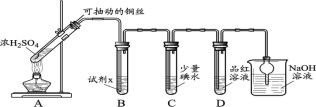
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
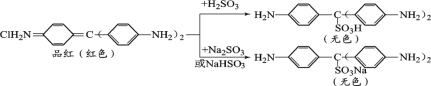
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在通常条件下反应制得,反应方程式为![]() 。
。
已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能( | 243 | a | 607 | 630 |
当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为___kJ。(用数字和字母表示)
(2)温度一定时,在一个体积为1L的密闭容器中通入2mol NO和1mol Cl2,10min时ClNO体积占气体总体积40%,反应开始到10min内NO的平均反应速率:![]() =___
=___![]() 。
。
(3)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图所示:
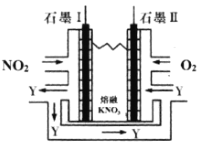
电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ为电源____极,石墨Ⅱ附近发生的电极反应式为___。
(4)含氮废水进入水体会造成富营养化,常使用次氯酸去除氨氮(以NH4+表示),生成无毒无害物质。次氯酸氧化除去氨氮的离子反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) KClO3 在 673K 时可分解为固体 A 和固体 B(物质的量之比为 3∶1),其中固体 A 所含元素与 KClO3 完全相同。写出相应的化学反应方程式 ___。比较KClO3 和固体 A 的热稳定性:KClO3_______固体 A(填“>”、“<”或“=”)。
(2)NaCN 各原子均满足 8 电子稳定结构。写出 NaCN 的电子式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com