
【题目】(1) KClO3 在 673K 时可分解为固体 A 和固体 B(物质的量之比为 3∶1),其中固体 A 所含元素与 KClO3 完全相同。写出相应的化学反应方程式 ___。比较KClO3 和固体 A 的热稳定性:KClO3_______固体 A(填“>”、“<”或“=”)。
(2)NaCN 各原子均满足 8 电子稳定结构。写出 NaCN 的电子式_________。
【答案】4KClO3![]() 3KClO4+KCl < Na+[:CN:]ˉ
3KClO4+KCl < Na+[:CN:]ˉ
【解析】
(1)KClO3 在 673K 时可分解为固体 A 和固体 B(物质的量之比为 3∶1),其中固体 A 所含元素与 KClO3 完全相同,KClO3 发生歧化反应,氯部分化合价升高,另一部分氯化合价降低,化学反应方程式 4KClO3![]() 3KClO4+KCl。从反应得出,KClO3 分解时固体 A 尚末分解,热稳定性:KClO3<固体A;
3KClO4+KCl。从反应得出,KClO3 分解时固体 A 尚末分解,热稳定性:KClO3<固体A;
故答案为:4KClO3![]() 3KClO4+KCl;<;
3KClO4+KCl;<;
(2)NaCN属于离子化合物,各原子均满足8电子稳定结构,CN-中碳和氮形成叁键,NaCN的电子式Na+[:CN:]ˉ;
故答案为:Na+[:CN:]ˉ。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应___(只需标出电子得失的方向和数目)。
(2)上述反应中氧化剂是___,氧化产物是___。
(3)反应中还原剂与氧化剂的物质的量之比为___。
(4)若反应中转移了0.3mol电子,则生成标准状况下NO的体积为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:
![]()
已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是
A.混合粉末应在 N2 氛围中进行加热,所用 H2SO4 溶液应先煮沸
B.取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成
C.滤渣用稀 H2SO4 溶解时应在通风橱中进行
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 分别用B、C、D表示反应的速率,其比值是3∶1∶2
C. 在2 min末时的反应速率,用产物C来表示是0.2mol·L-1·min-1
D. 在这2 min内用B和C表示的反应速率的值都是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
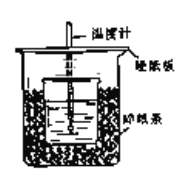
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________;由图可知该装置有不妥之处,应如何改正?___________________________________________________.
(2)烧杯间填满碎塑料泡沫的作用是__________________________________________.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值___________(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式
①H2SO4—____________________;
②Ba(OH)2—____________________;
③NaCl—____________________;
④CuSO4—____________________;
⑤Na2CO3—____________________;
⑥NH4NO3—____________________;
(2)写出下列微粒的结构示意图
①H____________________;
②Na____________________;
③O2-____________________;
④Mg2+____________________;
⑤最外层电子数为次外层电子数2倍的原子____________________;
⑥第二层电子数为第一层、第三层电子数之和的原子:______________________;
⑦氢元素存在着氕氘氚三种原子,它们的原子核内都含有一个质子,中子数分别为0、1、2,请用![]() 表示这三个原子____________________________________,这三种原子的关系是互为_____________。
表示这三个原子____________________________________,这三种原子的关系是互为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com