
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2 。然后以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
A. V甲=V乙>V丙 B. V丙>V乙>V甲 C. V乙>V丙>V甲 D. V甲=V乙=V丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与笑气(N 2O)的密度相同,则该 混合气体中二氧化硫、氮气、二氧化碳的质量比为( )
A. 4:5:6 B. 22:1:14
C. 64:35:13 D. 29:8:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征2号火箭承担运载“神六”的使命。氢化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭发射的优良炸药。下列说法正确的是( )
A. LiH、LiD、LiT的摩尔质量之比为1:2:3
B. 它们互称同分异构体
C. H、D、T之间互称同素异形体
D. 它们都是强还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为________。
(2)进水pH对氨氮去除率和出水pH的影响如图所示
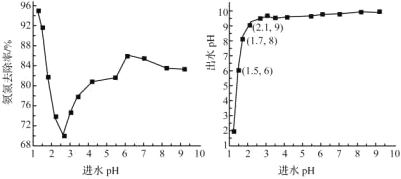
①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_______
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是______
③进水pH应控制在______左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_______(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子结构的说法,正确的是( )
A. 决定元素种类的是—电子数
B. 决定元素化学性质的是—原子的核外电子数
C. 决定元素相对原子质量的是—中子数
D. 决定元素周期表中原子序数的是—核电荷数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
(1)操作A、B的名称分别是______、_____;加入稍过量的NH4HCO3溶液的作用是_______。
(2)写出在空气中充分加热煅烧FeCO3的化学方程式:__________。
II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
(3)写出滴定过程中发生反应的离子方程式:_________。
(4)确定滴定达到终点的操作及现象为_________。
(5)上述样品的质量分数为_________。
(6)下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有______。
a.未干澡锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com