
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 分别用B、C、D表示反应的速率,其比值是3∶1∶2
C. 在2 min末时的反应速率,用产物C来表示是0.2mol·L-1·min-1
D. 在这2 min内用B和C表示的反应速率的值都是不同的
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
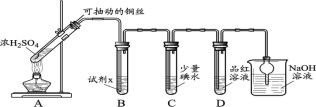
(1)装置A中发生反应的化学方程式____________。
(2)装置B中的试剂x是____________。
(3)小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是____________。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置 | 序号 | 试剂a | 实验现象 |
| i | 0.1 mol/L SO2溶液(pH=2) | 红色逐渐变浅,之后完全褪色 |
ii | 0.1 mol/L NaHSO3溶液(pH=5 ) | 红色立即变浅,之后完全褪色 | |
iii | 0.1 mol/L Na2SO3溶液( pH=10) | 红色立即褪色 | |
iv | pH=2H2SO4溶液 | 红色无明显变化 | |
v | 试剂a | 红色无明显变化 |
①实验 iii中Na2SO3溶液显碱性的原因_____________(结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH-对品红褪色的影响,则试剂a可能
是__________溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
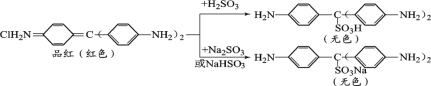
③通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆性
①甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因__________。
②乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式___________。
③丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
则反应2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200 mL饱和食盐水(惰性电极),一段时间后,阴极收集到标况下的氢气2.24 L(设电解后溶液体积不变)。
①二甲醚燃料电池的正极反应式为:___________,负极反应式为:_____________。
②请写出电解食盐水的化学方程式:____________________。
③电解后溶液的c(OH-)=________,理论上消耗二甲醚的质量为________(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
A.1mol<n<2molB.1mol<n<4mol
C.2mol<n≤4molD.1mol<n≤4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) KClO3 在 673K 时可分解为固体 A 和固体 B(物质的量之比为 3∶1),其中固体 A 所含元素与 KClO3 完全相同。写出相应的化学反应方程式 ___。比较KClO3 和固体 A 的热稳定性:KClO3_______固体 A(填“>”、“<”或“=”)。
(2)NaCN 各原子均满足 8 电子稳定结构。写出 NaCN 的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼矿主要含MoS2,还含有Ca、Si、Cu、Zn、Fe等元素。利用辉钼矿制备仲钼酸铵的新一代清洁生产工艺如下图所示:
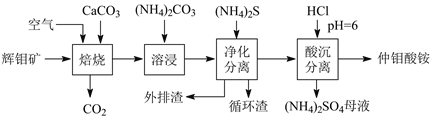
回答下列问题:
(1)焙烧温度为400℃,MoS2转化为CaMoO4和CaSO4,则反应中每摩MoS2转移的电子数为_________。仲钼酸铵(七钼酸铵)中的阴离子是Mo7O24n-,则n=_______。
(2)传统焙烧是在650℃下,使MoS2直接与空气中的O2反应生成MoO3和SO2。图示清洁生产工艺加入CaCO3的优点是______________。
(3)溶浸时,CaMoO4发生复分解反应的化学方程式是___________。循环渣的主要成分是CaCO3,则外排渣主要是________和Cu、Zn、Fe的硫化物。
(4)已知:常温下Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6。在(NH4)2SO4母液中添加循环渣(CaCO3),可以使硫酸铵转化为碳酸铵(返回溶浸循环使用),原因是_______。
(5)电氧化分解钼精矿时,用惰性电极电解钼精矿和NaCl的混合浆液,电解槽无隔膜,控制溶液pH=9。阴极生成物为________,混合浆液中,阳极产物转化生成的NaClO氧化MoS2生成MoO42-和SO42-的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-VOCl2电池是一种基于阴离子传导的新型二次电池,其简化装置示意图如下。总反应为Mg+2VOCl2![]() MgCl2+2VOCl,下列说法错误的是
MgCl2+2VOCl,下列说法错误的是

A.采用Mg作电极材料比Li的安全性更高
B.为该电池充电时Mg电极应与电源的正极相连
C.放电时正极反应为VOCl2+e-= VOCl+Cl-
D.放电过程中Cl-穿过复合离子液体向Mg移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种常见的燃料,也是重要的基础化工原料。回答下列问题:
(1)采用甲醇气相氨化法可制得二甲胺。
已知:2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122kJ/mol
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol
4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol
则制备二甲胺反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g)的H=_____ kJ/mol。
(2)一定条件下,甲醇气相氨化法原料气中c(CH3OH):c(NH3)分别为1:1、2:1、3:1时,NH3的平衡转化率随温度变化的关系如图:
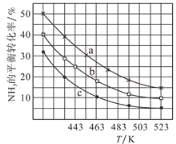
①代表原料气中c(CH3OH):c(NH3)=1:1的曲线是________。
②一定温度下,控制原料气中c(CH3OH):c(NH3)=3:1,能增大NH3平衡转化率的措施是_______。
③温度为443K时,按c(CH3OH):c(NH3)=2:1投料,若NH3的起始浓度为2mol/L,则反应达到平衡时,(CH3)2NH的体积分数为_______,该温度下的化学平衡常数为________ 。
(3)甲醇可通过电化学方法由甲烷直接制得,装置如下图所示,电解生成CH3OH的过程分为3步:

①通电时,氯离子先转化为高活性的原子氯(Cl·);
②Cl·与吸附在电极上的CH4反应生成HCl和CH3Cl;
③在碱性电解液中,CH3Cl转化为目标产物CH3OH。
步骤①的电极反应式为__________,步骤③的离子方程式为__________,维持电流强度为1.5A,装置工作2小时,理论上可制得CH3OH的质量为________g。(已知F=96500C/mol,不考虑气体溶解等因素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com