
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第二代复合火箭推进剂发生的反应可表示为:①2NH4ClO4→N2↑+Cl2↑+2O2↑+4H2O;②4Al(s)+3O2(g)→2Al2O3(s)+QkJ(Q>0)。完成下列填空:
(1)书写H2O的电子式____________________,Cl原子核外有______种不同能量的电子。
(2)上述物质所形成的晶体中,只包含一种微粒间作用力的是________(填序号)。
a. N2 b. Al2O3 c. H2O d. NH4ClO4
(3)N2和O2都能与H2反应,但二者反应条件差异较大,分析可能原因:①从分子断键角度看,N2分子更难断键,原因是_________________________________;②从原子成键角度看,O原子更易与H原子结合,原因是______________________________________________。
(4)反应①中,氧化产物是_______;生成1molN2时,反应中转移_______NA电子。铵盐都易分解,NH4Cl、NH4HCO4等受热分解得到NH3和相应的酸,而NH4NO3等铵盐和NH4ClO4分解相似,一般无法得到对应酸,且产物可能为N2或NO等物质。请分析不同铵盐受热分解产物存在差异的可能原因:__________。
(5)下列能量变化示意图可与反应②中所体现的能量关系匹配的是________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 物质的量浓度相同的NaOH溶液和氨水:c(Na+)>c(NH4+)
B. 物质的量浓度相同的盐酸和醋酸溶液,前者c(OH-)更小
C. 将相同体枳相同物质的量浓度的NaOH溶液和醋酸溶液混合后呈碱性,说明醋酸是弱电解质
D. pH=3的盐酸和pH=11的氨水混合后pH>7,说明氨水是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化学试剂。某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验(装置可重复使用):

(1)实验室将钙保存在________中(填物质名称)。氮化钙中所含化学键类型是_________。
(2)气体从左至右,装置连接顺序为____________________________。(填代号)
(3)写出A中发生反应的化学方程式:______________________________。
(4)用化学方法检验氮化钙(Ca3N2)产品中是否混有Ca,设计实验方案:________。
Ⅱ.测定产品纯度。
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是___________________________________。
(6)取产品质量为w g,开始量气管读数为V1 mL,最终量气管读数为V2 mL(折合成标准状况),则该样品纯度为________________________(用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组物质性质的比较,结论正确的是(____________)
A. 分子的极性:![]() B. 物质的硬度:
B. 物质的硬度:![]()
C. 物质的沸点:![]() D.在
D.在![]() 中的溶解度:
中的溶解度:![]()
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)![]() 位于元素周期表中第四周期____族,基态
位于元素周期表中第四周期____族,基态![]() 原子核外未成对电子有_____个。
原子核外未成对电子有_____个。
(2)![]() 可与
可与![]() 反应生成
反应生成![]() ,新生成的化学键为_____键。
,新生成的化学键为_____键。![]() 分子的空间构型为______,其中N原子的杂化轨道类型为_______。
分子的空间构型为______,其中N原子的杂化轨道类型为_______。
(3)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm, ![]() 中锰的原子半径为_____pm。已知阿伏加德罗常数的值为
中锰的原子半径为_____pm。已知阿伏加德罗常数的值为![]() ,
, ![]() 的理论密度
的理论密度![]() ____
____![]() 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____,其配位数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:
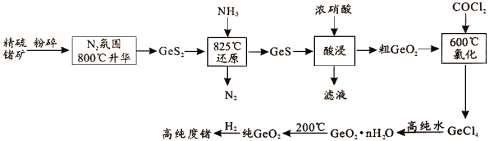
(1)锗在元素周期表中的位置是__________。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是______________。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式____。酸浸时温度不能过高的原因是_____
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为_____。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。

A.冰水浴
B.冰盐水浴
C.49℃水浴
(5)请判断25℃时0.1mol·L-1NaHGeO3溶液pH________(填“>”=”或“<”)7,理由是____(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A. 钢铁吸氧腐蚀中的正极反应:4OH--4e-=2H2O +O2
B. 由Na和Cl形成离子键的过程:![]()
C. NaHCO3的水解平衡:HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
D. 实验室制乙炔的反应:CaC2+H2O →CaO+C2H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com