
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
【答案】Na2SO3+H2SO4(浓) ===Na2SO4+H2O+SO2↑ 变红 酸性 褪色 漂白 有淡黄色沉淀生成 氧化 高锰酸钾溶液褪色 还原 吸收二氧化硫,防止二氧化硫污染环境 SO2+2NaOH===Na2SO3+H2O
【解析】
(1)亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠和水;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸可以使紫色石蕊试液变红;
(3)根据二氧化硫具有漂白性分析;
(4)根据二氧化硫具有氧化性,H2S具有还原性分析;
(5)根据二氧化硫具有还原性分析;
(6)二氧化硫有毒,不能直接排放到空气中,为酸性氧化物能够与氢氧化钠反应生成亚硫酸钠和水。
(1)⑥中为亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为二元中强酸,可以使紫色石蕊试液变红,即①中的实验现象为紫色石蕊试液变红,此实验证明二氧化硫是酸性气体;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H20,所以③中的实验现象是有淡黄色沉淀生成;
(5)二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化而使其褪色;
(6)二氧化硫有毒,不能直接排放到空气中,二氧化硫能够与氢氧化钠反应生成亚硫酸钠和水,所以可以用氢氧化钠溶液吸收二氧化硫,即⑤的作用是吸收二氧化硫,防止二氧化硫污染环境,反应的化学方程式为SO2+2NaOH=Na2SO3+H2O。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】【化学一选修3: 物质结构与性质】
(1)CH3COONH2 分子中各元素第一电离能大小顺序__________,该物质中碳原子杂化方式为_______________________________。
(2)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4) 等弱碱。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
比较上表中氨(NH3)、联氨(N2H4) 的熔、沸点,解释其高低的主要原因________,![]() 的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
(3)浅红色Cr [(H2O)3(NH3)3]Cl3中铬离子价电子排布式为__________________。
(4)SiC具有高硬度,高耐磨性,高耐腐蚀性和较高的高温强度特点,已成为一种重要的工程材料,其晶体具有六方ZnS 型结构。晶胞参数a=308pm,c=505pm,已知C原子的分数坐标(0,0,0)和(![]() ,
,![]() ,
,![]() );Si原子的分数坐标(0,0,
);Si原子的分数坐标(0,0,![]() )和((
)和((![]() ,
,![]() ,
,![]() )
)
①按比例在下框中商出SiC 六方晶胞_______

②列式计算Si-C的键长_______(保留整数部分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为VL;③pH=2的硫酸;④pH=12的氢氧化钠溶液.下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大十倍,所得溶液pH变为a﹣1
B.V1L③和V2L④混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④等体积混合后,混合液pH=7
D.①与③两溶液的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:_________,核外有_________种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
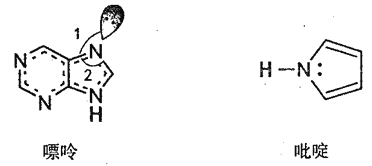
①嘌呤中所有元素的电负性由大到小的顺序__________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_____________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是______。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰___冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因______。
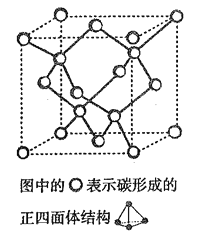
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是: 将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( ) 
A.氢气的燃烧热△H=﹣241.8 kJmol﹣1
B.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低
C.液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJmol﹣1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com