
【题目】依据如图判断,下列说法正确的是( ) 
A.氢气的燃烧热△H=﹣241.8 kJmol﹣1
B.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低
C.液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJmol﹣1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
【答案】C
【解析】解:图象分析可知2mol氢气和1mol氧气反应生成气体水2mol放热483.6KJ/mol,方程式:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6KJ/mol,2mol气体水变化为2mol液体水放热88KJ/mol,热化学方程式为:2H2O(g)=2H2O(l)△H=﹣88KJ/mol,
A.①2H2(g)+O2(g)=2H2O(g)△H=﹣483.6KJ/mol,
②2H2O(g)=2H2O(l)△H=﹣88KJ/mol,
盖斯定律计算①+②得到:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6KJ/mol,燃烧热为285.8KJ/mol,故A错误;
B.图中可知反应为放热反应,2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高,故B错误;
C.依据A的计算得到的热化学方程式2H2(g)+O2(g)=2H2O(l)△H=﹣571.6KJ/mol,则液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJmol﹣1,故C正确;
D.热化学方程式为:2H2O(g)=2H2O(l)△H=﹣88KJ/mol,H2O(g)生成H2O(l)时,放出热量,变化过程为物理变化,故D错误;
故选C.
图象分析可知2mol氢气和1mol氧气反应生成气体水2mol放热483.6KJ/mol,方程式:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6KJ/mol,2mol气体水变化为2mol液体水放热88KJ/mol,热化学方程式为:2H2O(g)=2H2O(l)△H=﹣88KJ/mol
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热为量为燃烧热;
B.2 mol H2(g)与1 mol O2(g)生成2 mol H2O(g) 的反应是放热反应;
C.依据2mol氢气和1mol氧气反应生成气体水2mol放热483.6KJ/mol,2mol气体水变化为2mol液体水放热88KJ/mol书写热化学方程式,结合盖斯定律得到液态水分解的热化学方程式分析;
D.H2O(g)生成H2O(l)时,是放热过程.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】化学式为C2H6O的化合物A具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH![]() 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是 ______ .
A.一定含有-OH B.一定含有-COOH C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用作 ______ .
(3)A与钠反应的化学方程式: ________________________________________ .
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为:________________ .
(5)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:___________________.
(6)如图是B分子的球棍模型和A分子的比例模型,若A和B的关系是同系物,则B的结构简式 ______ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图. 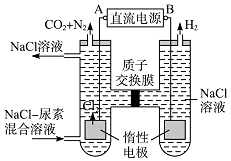
(1)电源的负极为(填“A”或“B”).
(2)阳极室中发生的反应依次为: , .
(3)电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素质量=g(忽略气体的溶解).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100个氨基酸共含有116个羧基和106个氨基,这些氨基酸缩合成6条多肽链时共含有—NH2个数是( )
A. 6 B. 12 C. 22 D. 100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.羰基硫(COS)可作为熏蒸剂,分子结构与CO2相似。回答下列问题:
(1)碳原子的核外电子排布式为____________;组成羰基硫的元素中,半径最大的原子其核外有_____种不同能量的电子。
(2)羰基硫为___(填“极性”或“非极性”)分子,羰基硫的电子式为_____________。
(3)解释稳定性CO2大于CS2的原因________________________________________。
II.密闭容器中,发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
(4)已知逆反应速率随时间变化如图所示,则t0时改变的条件可能是_____________或________________。

(5)该反应达到平衡后,其他条件不变,升高温度,H2S浓度增加,表明该反应是___(填“放”或“吸”)热反应,平衡常数K将____(填“增大”、“减小”或“不变”);若在反应体系中通入一定量SO2(g),判断平衡移动的方向并解释原因。 ________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com