
【题目】把金属钠投入下列溶液中,既有气体放出,又有白色沉淀生成的是 ( )
A.盐酸B.氯化钠溶液C.氯化铜溶液D.氯化镁溶液
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为VL;③pH=2的硫酸;④pH=12的氢氧化钠溶液.下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大十倍,所得溶液pH变为a﹣1
B.V1L③和V2L④混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④等体积混合后,混合液pH=7
D.①与③两溶液的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( ) 
A.氢气的燃烧热△H=﹣241.8 kJmol﹣1
B.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低
C.液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJmol﹣1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 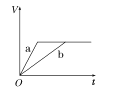 B.
B. 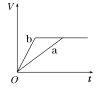 C.
C. 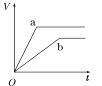 D.
D. 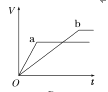
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. a—定由W、X两种元素组成
D. 图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6(相对分子质量176),人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸.在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如纯天然橙汁中维生素C的含量在500mg/L左右.某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告.(请填写有关空白) ⑴测定目的:测定××牌软包装橙汁中维生素C的含量.
⑵测定原理:C6H8O6+I2→C6H6O6+2H++2I﹣
(1)实验用品及试剂 ①仪器和用品(略)
②试剂:指示剂(填名称),浓度为7.50×10﹣3molL﹣1的I2标准溶液、蒸馏水等.
(2)实验过程 ①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②用(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶
液颜色变化,直到滴定终点.滴定至终点时的现象是 .
(3)数据记录与处理 若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是mol/L.从分析数据看,此软包装橙汁是否是纯天然橙汁?(填“是”或“不是”或“可能是”)
(4)问题讨论:下列操作会导致所测维生素C的含量偏高的是(填字母编号).
A.若滴定结束后读数采用仰视
B.若锥形瓶用待测橙汁润洗过
C.若取标准液的滴定管水洗后未用待装液润洗
D.若锥形瓶中含有少量水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com