
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图. 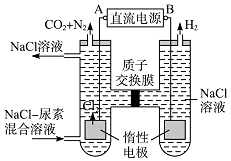
(1)电源的负极为(填“A”或“B”).
(2)阳极室中发生的反应依次为: , .
(3)电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素质量=g(忽略气体的溶解).
【答案】
(1)B
(2)2Cl﹣﹣2e﹣=Cl2↑; CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
(3)不变;7.2
【解析】解:(1)由图可知,左室电极产物为CO2和N2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源的负极,故答案为:B;(2)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl﹣﹣2e﹣═Cl2↑,
CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:2Cl﹣﹣2e﹣=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;(3)阴极反应为6H2O+6e﹣═6OH﹣+3H2↑(或6H++6e﹣═3H2↑)
阳极反应为6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH﹣、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH﹣恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
电解收集到的13.44 L气体,物质的量为 ![]() =0.6mol,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知n(N2)=n(CO2)=0.6mol×
=0.6mol,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知n(N2)=n(CO2)=0.6mol× ![]() =0.12 mol,
=0.12 mol,
可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]=0.12 mol×60 gmol﹣1=7.2 g,
故答案为:不变;7.2.
(1)根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物CO2和N2可以判断出A为电源的正极,B为电源的负极;(2)由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl;(3)阴极反应为:6H2O+6e﹣═6OH﹣+3H2↑(或6H++6e﹣═3H2↑)
阳极反应为:6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH﹣、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH﹣恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
根据n= ![]() 计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.
计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
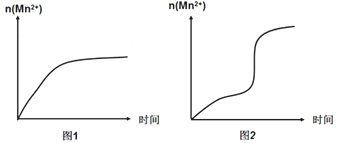
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×10﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示:
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.1 molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2Cl﹣
Cu2++2Cl﹣
B.铅蓄电池放电时,负极增重:Pb﹣2e﹣+SO42﹣=PbSO4
C.向碳酸钠溶液中滴加酚酞时,溶液变红:CO32﹣+2H2OH2CO3+2OH﹣
D.明矾可用于净水:Al3++3H2OAl(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( ) 
A.氢气的燃烧热△H=﹣241.8 kJmol﹣1
B.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低
C.液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJmol﹣1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 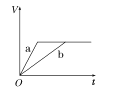 B.
B. 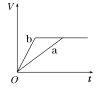 C.
C. 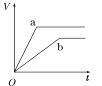 D.
D. 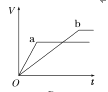
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )

A. 该反应为吸热反应
B. 该反应不需要加热就能进行
C. 1 molCO(g)和1mol H2O(g)具有的总能量大于1 molCO2(g)和1 molH2(g)具有的总能量
D. 1 molCO2(g)和1 molH2(g)反应生成1 molCO(g)和1mol H2O(g)要放出41 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com