
����Ŀ��I.�ʻ���(COS)����ΪѬ���������ӽṹ��CO2�������ش��������⣺
��1��̼ԭ�ӵĺ�������Ų�ʽΪ____________������ʻ����Ԫ���У��뾶����ԭ���������_____�ֲ�ͬ�����ĵ��ӡ�
��2���ʻ���Ϊ___(���������������Ǽ�����)���ӣ��ʻ���ĵ���ʽΪ_____________��
��3�������ȶ���CO2����CS2��ԭ��________________________________________��
II.�ܱ������У�������Ӧ��CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
��4����֪�淴Ӧ������ʱ��仯��ͼ��ʾ����t0ʱ�ı������������_____________��________________��

��5���÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ�H2SŨ�����ӣ������÷�Ӧ��___���������������������ȷ�Ӧ��ƽ�ⳣ��K��____(����������������С������������)�����ڷ�Ӧ��ϵ��ͨ��һ����SO2(g)���ж�ƽ���ƶ��ķ�����ԭ�� ________________________
���𰸡� 1s22s22p2 5 ���� ![]() C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2 ������� ��С�������������ѹǿ�� �� ��С �����ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���
C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2 ������� ��С�������������ѹǿ�� �� ��С �����ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���
����������1��̼ԭ�Ӻ˵����Ϊ6����������Ų�ʽΪ1s22s22p2��C��O��S����ԭ������Sԭ�ӵ��Ӳ������S��ԭ�Ӱ뾶�������������Ų�Ϊ��1s22s22p63 s23p4����ԭ��ԭ���������5�ֲ�ͬ�����ĵ��ӣ���ȷ�𰸣�1s22s22p2 �� 5��
��2���ʻ�����ӽṹ��![]() ������Ϊֱ���ͽṹ���ṹʽΪ:
������Ϊֱ���ͽṹ���ṹʽΪ:![]() ,��COS �ĵ���ʽΪ
,��COS �ĵ���ʽΪ![]() ����O��S�õ��ӵ�������ͬ����Ϊ��C��O֮����C��S֮��ļ��Լ��ļ��Է�������ȷ����������
����O��S�õ��ӵ�������ͬ����Ϊ��C��O֮����C��S֮��ļ��Լ��ļ��Է�������ȷ����������![]() ��
��
��3��ԭ�Ӱ뾶��S>C>O������C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2 ����ȷ����C��O˫�����ܴ���C��S˫�����ܣ������ȶ���CO2����CS2��
II.��4��t0ʱ���淴Ӧ����ͻȻ�����Ҳ��䣬˵��ƽ�ⲻ�������ڸ÷�ӦΪ��Ӧǰ���������Ŀ��淴Ӧ�����Կ�����С������������ڴ�����ƽ���ƶ���Ӱ�죬���ǿ��Լӿ췴Ӧ���ʣ����Ҳ���Լ����������ȷ�𰸣���������� ��С�������������ѹǿ����
��5������CO(g)+H2S(g)![]() COS(g)+H2(g) ��Ӧ���÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ�H2SŨ�����ӣ���Ӧ����������÷�ӦΪ���ȷ�Ӧ��ƽ�ⳣ��K����С�����ڷ�Ӧ��ϵ��ͨ��һ����SO2(g)����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ�����ȷ�𰸣��� ����С�������ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���
COS(g)+H2(g) ��Ӧ���÷�Ӧ�ﵽƽ��������������䣬�����¶ȣ�H2SŨ�����ӣ���Ӧ����������÷�ӦΪ���ȷ�Ӧ��ƽ�ⳣ��K����С�����ڷ�Ӧ��ϵ��ͨ��һ����SO2(g)����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ�����ȷ�𰸣��� ����С�������ƶ�����ΪSO2��H2S��Ӧ��ʹc(H2S)���������������ƶ���


 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�жϣ�����˵����ȷ���ǣ������� 
A.������ȼ���ȡ�H=��241.8 kJmol��1
B.2 mol H2��g����1 mol O2��g���������������2 mol H2O��g�� �������������
C.Һ̬ˮ�ֽ���Ȼ�ѧ����ʽΪ��2H2O��l��=2H2��g��+O2��g����H=+571.6 kJmol��1
D.H2O��g������H2O��l��ʱ���ϼ����յ�����С�ڳɼ��ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��SO2����ͨ��Ba(NO3)2��Һ | �а�ɫ���� | SO2�л���SO3 |
B | ��NaAlO2��Һ�г���ͨ������Y | �ȳ��ְ�ɫ���������ճ������ܽ� | Y������CO2���� |
C | AgCl����Һ�е�������Na2S��Һ | �������ɫ | Ksp(Ag2S)>Ksp(AgCl) |
D | ��ʢ��KI3��Һ�����Թ��зֱ���������Һ��AgNO3��Һ | ǰ����Һ����ɫ�������л�ɫ���� | KI3��Һ�д���ƽ��: I3�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO(g)��H2O(g)��Ӧ�������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ����(����)

A. �÷�ӦΪ���ȷ�Ӧ
B. �÷�Ӧ����Ҫ���Ⱦ��ܽ���
C. 1 molCO(g)��1mol H2O(g)�������������1 molCO2(g)��1 molH2(g)���������
D. 1 molCO2(g)��1 molH2(g)��Ӧ����1 molCO(g)��1mol H2O(g)Ҫ�ų�41 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ұ����������ʵķ����У�����ȷ����
A.���������Ʊ�����ú����
B.Ũ���ᱣ���ڳ����Լ�ƿ��
C.FeSO4��Һ�����ڼ����������۵��Լ�ƿ��
D.����װ����ɫ�Լ�ƿ���ܷ�ܹⱣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Aԭ�ӵ�L���Bԭ��L����3�����ӣ�Bԭ�Ӻ������������Aԭ�Ӷ�5�����ɴ�AB���γɣ� ��
A.���ӻ�����B2A3B.���ӻ�����B3A2C.���ۻ�����B3A2D.���ۻ�����B2A3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C��һ��ˮ����ά���أ���ˮ��Һ�����ԣ������Ļ�ѧʽ��C6H8O6����Է�������176��������ȱ��������ά�����ܵû�Ѫ֢������ά����C�ֳƿ���Ѫ�ᣮ�����ʵ�ˮ�����߲ˡ�����Ʒ�ж�����ά����C�����紿��Ȼ��֭��ά����C�ĺ�����500mg/L���ң�ijУ����С��ⶨ��ij���ӵ�����װ��֭��ά����C�ĺ����������Dzⶨʵ��������森������д�йؿհף� �ŲⶨĿ�ģ��ⶨ����������װ��֭��ά����C�ĺ�����
�Ʋⶨԭ����C6H8O6+I2��C6H6O6+2H++2I��
��1��ʵ����Ʒ���Լ� ����������Ʒ���ԣ�
���Լ���ָʾ���������ƣ���Ũ��Ϊ7.50��10��3molL��1��I2����Һ������ˮ�ȣ�
��2��ʵ����� ��ϴ�����������ζ����Ƿ�©Һ����ϴ��װ�ñ�����Һ���ã�
���������������ƣ�����ƿ������20.00mL�����֭������2��ָʾ����
�������ֿ��Ƶζ��ܵ����λ��������ҡ����ƿ���۾�ע����ƿ����
Һ��ɫ�仯��ֱ���ζ��յ㣮�ζ����յ�ʱ�������� ��
��3�����ݼ�¼�봦�� �������ݴ������ζ������ı�����Һ�������15.00mL����˳�֭��ά����C�ĺ�����mol/L���ӷ������ݿ���������װ��֭�Ƿ��Ǵ���Ȼ��֭������ǡ����ǡ������ǡ���
��4���������ۣ����в����ᵼ������ά����C�ĺ���ƫ�ߵ���������ĸ��ţ���
A.��������������������
B.����ƿ�ô����֭��ϴ��
C.��ȡ��Һ�ĵζ���ˮϴ��δ�ô�װҺ��ϴ
D.����ƿ�к�������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֽ���������ʳƷ��������ij�ֶ��ɵ����ϱ��У��ٴ���ֲ���ͣ���ʳ���Σ��ܰ�ɰ�ǣ������ʻơ�
��1�����������ʵ���_________(����ţ���ͬ)��
��2��������֬����_________��
��3�������������_________��
��4��������ɫ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ijɷ���ҪΪFeCr2O4������������Al2O3��SiO2���Ӹ���������ȡ�������Ļ�����,����ø�����Ĺ�������������
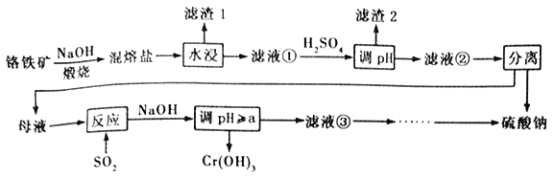
��֪�������Ρ��к���Na2CrO4��NaFeO2������NaFeO2����ˮ�⡣�Իش�����������
��1��������1��Ϊ���ɫ�������仯ѧʽΪ_________________������Һ���м�H2SO4����pH����Ŀ����һ��ʹCrO42-ת��ΪCr2O72- ������____________________________��
��2�������ա�������ʱ����Ҫ��Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3��������ͼ�ܽ��(S)~�¶�(T)�����ж�������Һ�����е���ѡ����롱����Ϊ_________(�����)��
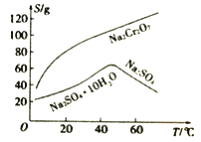
A.�����ᾧ B.����Ũ�������ȹ��� C.����Ũ������ȴ�ᾧ������
��4������Ӧ�������ӷ���ʽΪ_______________________________��
��5��Cr(OH)3������������������[CrCln(H2O) 6-n]x+��0.0015 mol [CrCln(H2O) 6-n]x+�������ӽ�����֬(HR)��ȫ�������ӽ�����
[CrCln(H2O) 6-n]x++xHR��Rx[CrCln(H2O) 6-n]+xH+�����ɵ�H+����25.00 mL0.1200 mol��L -1NaOH��Һǡ���к͡���������ӵĻ�ѧʽΪ__________________��
��6����֪25��ʱ��Cr(OH)3���ܶȻ�����Ksp[Cr(OH)3]=1.0��10-32����ʹCr3+ǡ����ȫ����������Һ��c(Cr3+) =1.0��10-5 mol��L -1ʱ��Ӧ������ҺpH����СֵaΪ����? (��ʽ����)____________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com