
【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在通常条件下反应制得,反应方程式为![]() 。
。
已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能( | 243 | a | 607 | 630 |
当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为___kJ。(用数字和字母表示)
(2)温度一定时,在一个体积为1L的密闭容器中通入2mol NO和1mol Cl2,10min时ClNO体积占气体总体积40%,反应开始到10min内NO的平均反应速率:![]() =___
=___![]() 。
。
(3)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图所示:
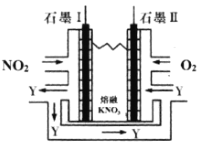
电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ为电源____极,石墨Ⅱ附近发生的电极反应式为___。
(4)含氮废水进入水体会造成富营养化,常使用次氯酸去除氨氮(以NH4+表示),生成无毒无害物质。次氯酸氧化除去氨氮的离子反应方程式是____。
【答案】![]() 0.1 正
0.1 正 ![]()
![]()
【解析】
(1)先依据所给的化学方程式找到转移电子数与放热的关系,然后列正比例式进行求算;
(2)利用三段式求出NO的浓度改变量,除以时间即可;
(3)明确价态变化,明确正负极,考虑题给信息,写出电极反应式;
(4)根据题给的信息,明确反应物和产物,利用化合价升降总数相等配平即可。
(1)从反应方程式2NO+Cl2![]() 2ClNO来看,每消耗1mol Cl2,转移2mol电子,放出的热量为(a+607)×2-2×630-243=(2a-289)kJ,所以转移4mol电子,放出热量为2×(2a-289)kJ=(4a-578)kJ;
2ClNO来看,每消耗1mol Cl2,转移2mol电子,放出的热量为(a+607)×2-2×630-243=(2a-289)kJ,所以转移4mol电子,放出热量为2×(2a-289)kJ=(4a-578)kJ;
(2) 根据化学方程式:
2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
初始 2 1 0
变化 2x x 2x
剩余 2-2x 1-x 2x
10min时ClNO体积占气体总体积的40%,则其物质的量分数也为40%,即![]() =0.4,解得x=0.5mol,所以开始到10min内NO的平均反应速率
=0.4,解得x=0.5mol,所以开始到10min内NO的平均反应速率![]() =0.1mol·L-1·min-1;
=0.1mol·L-1·min-1;
(3)石墨II处通入了O2,发生了还原反应,对应原电池的正极。发生的电极反应式为:O2+N2O5+4e-=2NO3-,注意看清图示中的N2O5进入了正极区域;
(4)次氯酸是强氧化剂,NH4+被氧化为氮气,反应的离子方程式为:2NH4++3HClO=N2↑+3H2O+5H++3Cl-。


科目:高中化学 来源: 题型:
【题目】一定温度下,把0.5molN2O4气体通入容积为5L的密闭容器中,60s时达到平衡,此时容器内的压强为起始时的1.6倍,求:
(1)在这60s内NO2的平均生成速率;_______
(2)达到平衡时N2O4的分解率。_______
(3)达到平衡时NO2 的体积百分含量_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应___(只需标出电子得失的方向和数目)。
(2)上述反应中氧化剂是___,氧化产物是___。
(3)反应中还原剂与氧化剂的物质的量之比为___。
(4)若反应中转移了0.3mol电子,则生成标准状况下NO的体积为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、D、E、F、G均为短周期主族元素,且原子序数依次增大,只有E为金属元素。已知A原子只有一个电子层;E、F的原子序数分别是B、D的2倍,其中D、F同主族,B、E不同主族。回答下列问题:
(1)元素D在周期表中的位置____。
(2)F和G形成的化合物,分子中所有原子均为8电子稳定结构,该化合物的电子式为____。
(3)由上述元素组成的物质中,按下列要求写出化学方程式
①两种弱酸反应生成两种强酸______;
②置换反应,且生成物在常温均为固态____。
(4)在D、F、G中选取2种元素组成具有漂白、杀菌作用的化合物___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用离子液体作电解液的混合动力电池放电原理图如图所示,已知充放电时的电池反应为4LiA12C17+3LiFePO4(s)![]() A1+3FePO4+7LiA1C14。下列说法正确的是
A1+3FePO4+7LiA1C14。下列说法正确的是
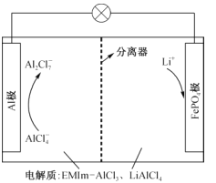
A.放电时,向正极迁移的是 Al3+
B.放电时,A1极上的电势比FePO4极上的高
C.充电时,阴极反应式:A12C17-+6e- = 2A1+7C1-
D.充电时,阳极反应式:LiFePO4—e- = FePO4+Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com