
【题目】一种用离子液体作电解液的混合动力电池放电原理图如图所示,已知充放电时的电池反应为4LiA12C17+3LiFePO4(s)![]() A1+3FePO4+7LiA1C14。下列说法正确的是
A1+3FePO4+7LiA1C14。下列说法正确的是
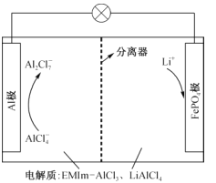
A.放电时,向正极迁移的是 Al3+
B.放电时,A1极上的电势比FePO4极上的高
C.充电时,阴极反应式:A12C17-+6e- = 2A1+7C1-
D.充电时,阳极反应式:LiFePO4—e- = FePO4+Li+
【答案】D
【解析】
由总反应式可以看出,放电时,Al失电子,则Al极作负极,发生反应Al-3e- +7A1C14- =4A12C17-;从而得出FePO4极为正极,电极反应3FePO4+3e-+3Li+=3LiFePO4(s)。
A.放电时,阳离子向正极迁移,但溶液中不含有Al3+,所以向正极迁移的是Li+而不是 Al3+,A不正确;
B.放电时,A1极为负极,其电势比FePO4极(正极)上的低, B不正确;
C.充电时,阴极反应式:4A12C17-+3e- =Al+7A1C14-,C不正确;
D.由电池反应式看,充电时,在阳极LiFePO4失电子转化为FePO4和Li+,所以电极反应式:LiFePO4-e- = FePO4+Li+,D正确;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 某试样焰色反应呈黄色,则试样中一定不含有![]()
B. 鉴别![]() 和
和![]() 溶液可用硝酸酸化的硝酸银溶液
溶液可用硝酸酸化的硝酸银溶液
C. 容量瓶不能用作溶解物质的容器
D. 粗盐的提纯实验中,滤液在蒸发皿中加热蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1molL﹣1的盐酸的体积为( )
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在通常条件下反应制得,反应方程式为![]() 。
。
已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能( | 243 | a | 607 | 630 |
当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为___kJ。(用数字和字母表示)
(2)温度一定时,在一个体积为1L的密闭容器中通入2mol NO和1mol Cl2,10min时ClNO体积占气体总体积40%,反应开始到10min内NO的平均反应速率:![]() =___
=___![]() 。
。
(3)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图所示:
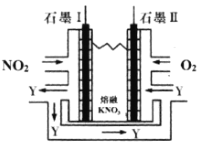
电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ为电源____极,石墨Ⅱ附近发生的电极反应式为___。
(4)含氮废水进入水体会造成富营养化,常使用次氯酸去除氨氮(以NH4+表示),生成无毒无害物质。次氯酸氧化除去氨氮的离子反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”的电化学实验装置如图所示。该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法错误的是
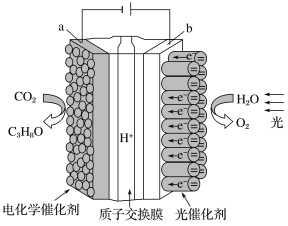
A. 该装置工作时,H+从b极区向a极区迁移
B. a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
C. 每生成1 mol O2,有44 g CO2被还原
D. C3H8O形成燃料电池以氢氧化钠溶液作为电解质溶液的负极反应式:C3H8O-18e-+24OH-=3CO32-+16H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,某种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用较长时间。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。
2K2CO3+6H2O。
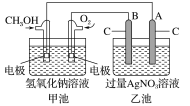
请填空:
(1)充电时,①燃料电池的负极与电源________极相连。
②阳极的电极反应式为:________________________。
(2)放电时:负极的电极反应式为:__________________。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2____________L(标准状况)。
(4)若在常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出B、C、E元素的名称B___________、C__________、E_____________。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为____________。
(3)不能验证C和F两种元素非金属性强弱的结论是(填编号)________。
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为________、________,这两种酸式盐相互反应的离子方程式为_______。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________。
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a﹣b)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com