
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
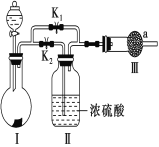
(1)过氧化钠与二氧化碳反应的化学方程式是_______________________________________________________,
该反应中,反应物的总能量________(填“大于”或“小于”)生成物的总能量。
(2)装置Ⅰ中的试剂是________(填字母)。
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹________(填“K1”或“K2”),观察到预期现象后,关闭它,再打开另一个弹簧夹。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是_______________________________________________________________________.
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是_______________________________________________________________________.
(5)为进一步达到实验目的,应补充的实验是:取最终反应后Ⅲ中所得固体,_______________________________________________________________________.
【答案】2Na2O2+2CO2===2Na2CO3+O2大于bcK2除去未充分反应的CO2水与Na2O2反应生成O2加入稀盐酸,将产生的气体通入澄清石灰水中(答案合理即可)
【解析】
(1)根据过氧化钠与二氧化碳反应生成碳酸钠和氧气;根据放热反应中,反应物的总能量大于生成物的总能量;(2)根据题意可知Ⅰ装置是二氧化碳的制备装置,根据二氧化碳的制备原理以及盐酸具有挥发性来确定反应物;(3)根据实验目的可以知道,先通入干燥的二氧化碳,来判断干燥的二氧化碳是否能够和过氧化钠反应,所以打开的止水夹为K2,可以据此解答;(4)①二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去二氧化碳,再进行检验,可以据此解答该题;②根据查阅资料部分可以知道,水也能够和过氧化钠反应生成氧气,可以据此解答该题;(5)盐酸可以和碳酸钠反应生成二氧化碳,二氧化碳能使澄清石灰水变混浊。
(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,该反应是放热反应,所以反应物的总能量大于生成物的总能量;(2)盐酸和碳酸钙反应时可能会带出一部分氯化氢,为了使实验更准确应该可用稀硫酸和小苏打反应制二氧化碳,故答案为:bc;(3)根据实验目的可以知道,先通入干燥的二氧化碳,来判断干燥的二氧化碳是否能够和过氧化钠反应,所以打开的止水夹为K2;(4)①二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去二氧化碳,再用带火星的木条来检验是否产生了氧气,故答案为:除去未充分反应的CO2;②根据查阅资料部分可以知道,水也能够和过氧化钠反应生成氧气,所以不能判断是二氧化碳和过氧化钠发生了反应,故答案为:水与Na2O2反应生成氧气;(5)Ⅲ中固体若有碳酸钠,盐酸可以和碳酸钠反应生成二氧化碳,二氧化碳能使澄清石灰水变混浊,故答案为:加入稀盐酸,将产生的气体通入澄清石灰水。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
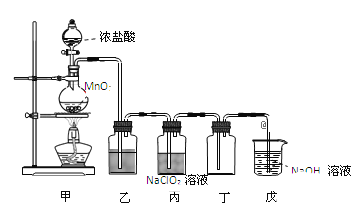
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO![]() 、ClO
、ClO![]() ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100 g 质量分数为46%的乙醇(CH3CH2OH)水溶液中氧原子数为4NA
B. 标况下,46g NO2所含分子数目为NA
C. 1 mol Cl2通入足量NaOH溶液中,转移电子数为2NA
D. 0.5mol/L 的H2SO4溶液中,含有H+的个数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:

已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理”时,需用Na2CO3调节溶液至微酸性而不是碱性,其原因是__________________。
(2)“还原Ⅰ”需在80 ℃条件下进行,适宜的加热方式为____________。
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为__________________。
(4)“搅拌”时加入NaCl粉末的作用是____________________________。
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70 ℃干燥2小时,冷却,密封包装。于70 ℃真空干燥的目的是__________________________。
(6)①设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:稀硫酸加到滤渣中,搅拌,充分反应至无气体产生为止,过滤并用蒸馏水洗涤2~3次,低温烘干。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:____________________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1 g,Cu2Cl2的质量为m2 g,则途径a、b铜元素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作,现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 向②(盛KI淀粉溶液)中通入少量的Cl2 | 溶液变蓝色 | Cl2与淀粉发生显色反应 |
C | 向③中溶液先滴加H2O2溶液,再滴加KSCN溶液 | 溶液变红色 | 原溶液中含有Fe2+ |
D | 向④中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应
满足的关系是( )
A. c(M+)>c(OH-)>c(A-)>c(H+)B. c(M+)>c(A-)>c(OH-)>c(H+)
C. c(M+)>c(A-)>c(H+)>c(OH-)D. c(M+)>c(H+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在强酸性和强碱性溶液中均能够大量共存的离子组是( )
A.NH4+、Cu2+、Cl-、NO3-B.K+、Na+、HCO3-、SO42-
C.Fe2+、NO3-、Na+、ClO-D.Cl-、NO3-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
2C(g)达到平衡时,各物质的物质的量之比是n(A)∶n(B) ∶n(C)=2∶2∶l。保持温度不变,以2∶2∶1的物质的量之比再充入A,B,C,则( )
A. 平衡向正方向移动 B. 平衡不发生移动
C. C的体积分数减小 D. C的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com