
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 100 g 质量分数为46%的乙醇(CH3CH2OH)水溶液中氧原子数为4NA
B. 标况下,46g NO2所含分子数目为NA
C. 1 mol Cl2通入足量NaOH溶液中,转移电子数为2NA
D. 0.5mol/L 的H2SO4溶液中,含有H+的个数为0.1NA
【答案】A
【解析】
A、乙醇的水溶液中乙醇中含有氧原子,H2O中含有氧元原子,100g46%乙醇(CH3CH2OH)中含有氧原子物质的量为(100g×46%)÷46g/mol=1mol,H2O中含有氧原子物质的量为(100g×54%)÷18g/mol=3mol,氧原子总物质的量为4mol,个数为4NA,故A正确;
B、由于存在平衡关系:N2O4![]() 2NO2,因此46gNO2所含分子数目不是NA,故B错误;
2NO2,因此46gNO2所含分子数目不是NA,故B错误;
C、Cl2与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O,因此1molCl2参与此反应转移电子物质的量为1mol,电子数为NA,故C错误;
D、没有说明溶液的体积,不能计算硫酸溶液中氢离子的物质的量,故D错误。
答案选A。


科目:高中化学 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列溶液:100mL 2 mol·L-1 KCl溶液、100 mL 1mol·L-1 CaCl2溶液和200 mL 1mol·L-1FeCl3溶液,上述三种溶液中Cl-物质的量浓度之比为
A.1 :1:3B.1 :1:1C.2 :2:3D.1 :2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在元素周期表中的位置。
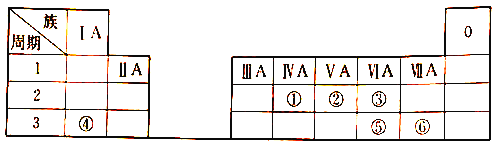
请回答下列问题:
(1) ①元素原子的质子数是_________。
(2)②元素的最简单氢化物的分子式是_______。
(3)③和⑤两种元素的非金属性: ③___⑤(填“>”“<”或“=”);
(4)④和⑥两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。回答下列问题:

(1)写出各物质的化学式:A.___,B.___,C.____,D.____,E.____。
(2)写出B→C、D→E反应的离子方程式:
B→C:____________________________________________________________;
D→E:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探索铜与浓硫酸的反应,用如图所示装置进行有关实验。
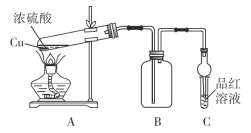
甲组取a g铜片和一定量的浓硫酸放入试管中加热,直到反应完毕,最后发现试管中还有一定量的H2SO4和Cu剩余。
(1)写出装置A中所发生反应的化学方程式:_______________________________。
(2)若用含0.2 mol H2SO4的浓硫酸与过量铜片共热,能否收集到0.1 mol SO2:______(填“能”或“不能”)。
(3)当集气瓶B中的气体收集满时,装置C中有可能观察到的现象是_____________。
(4)为什么有一定量的余酸却未能使Cu完全溶解,你认为原因是_________________。
(5)乙组同学认为:实验装置C有可能造成环境污染,乙组同学设计了最简单方法给予解决:在C试管口塞上一团沾有_________(填化学式)溶液的棉花。
(6)为了证明反应结束后的试管中的确有剩余的稀硫酸,可选择的试剂是_______。
A.铁粉 B.Na2CO3溶液 C.BaCl2溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)PHB塑料是一种在微生物作用下可降解成无机物的环保型塑料,工业上可用异戊二烯合成:

已知:

(—R1、—R2、—R3、—R均为烃基)
请回答下列问题:
(1)A用系统命名法命名为_____,D中官能团的名称是_______。
(2)反应①的反应类型为_______________。
(3)B与H2反应后的产物的结构简式为![]() ,则B的结构简式为_____。
,则B的结构简式为_____。
(4)写出反应④的化学方程式:_________________________________。
(5)C的同分异构体X满足下列条件:
①能发生水解反应和银镜反应;②1个分子中含有2个碳氧双键。则符合条件的X共有______种。
另一种同分异构体Y能与碳酸钠溶液反应放出气体,能发生银镜反应,核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则Y的结构简式为_________。
(6)参照PHB的上述合成路线,设计一条由D为起始原料制备 的合成路线(其他试剂任选)______________。
的合成路线(其他试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
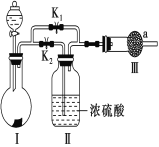
(1)过氧化钠与二氧化碳反应的化学方程式是_______________________________________________________,
该反应中,反应物的总能量________(填“大于”或“小于”)生成物的总能量。
(2)装置Ⅰ中的试剂是________(填字母)。
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹________(填“K1”或“K2”),观察到预期现象后,关闭它,再打开另一个弹簧夹。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是_______________________________________________________________________.
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是_______________________________________________________________________.
(5)为进一步达到实验目的,应补充的实验是:取最终反应后Ⅲ中所得固体,_______________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,C和H2O(g)在密闭容器里发生下列反应:
①C(s)+H2O(g)![]() CO(g)+H2(g), ②CO(g)+H2O(g)
CO(g)+H2(g), ②CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
A. CO在平衡时转化率为10%
B. 平衡浓度c(CO2)=c(H2)
C. 平衡时气体平均相对分子质量约为23.3
D. 其他条件不变时,缩小体积,H2O(g)的转化率随之降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com