
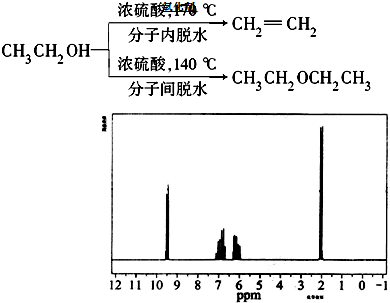
| ˮ |
| �� |
| ŨH2SO4 |
| �� |
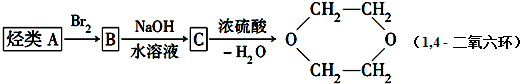
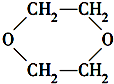 +2H2O����Ӧ������ȡ����Ӧ��
+2H2O����Ӧ������ȡ����Ӧ��| ˮ |
| �� |
| ŨH2SO4 |
| �� |
 +2H2O��ȡ����Ӧ��
+2H2O��ȡ����Ӧ��


 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��CH3OH��l��+3
| ||
| B��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l����H=-1452 kJ?mol-1 | ||
| C��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l����H=-725.8 kJ?mol-1 | ||
| D��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��l����H=+1452 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | �����Ӧ | ԭ������ |
| A | ˮ�ڸ������ѷֽ� | ˮ����֮�������� |
| B | �����ھƾ��ƻ����ϼ����ۻ��������� | Al2O3�۵����Al���� |
| C | ���Ȼ�������ˮ�γɵ�����Һ�������м���KI���ɻ�ɫ���� | Ksp��AgI����Ksp��AgCl�� |
| D | 2CO=2C+O2���κ������¾������Է����� | �÷�Ӧ��H��0����S��0 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��4.48g |
| B��3.36g |
| C��3.25g |
| D��2.80g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��C3H6 |
| B��C4H6 |
| C��C3H4 |
| D��C2H4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���100mL 0.01mol?L-1 HA��Һ����μ���0.02mol?L-1MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ���������˵��������ǣ�������
�����£���100mL 0.01mol?L-1 HA��Һ����μ���0.02mol?L-1MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������仯���Բ��ƣ���������˵��������ǣ�������| A�������£�MA��ˮ��Һ��pH=a����ˮ���������c��H+��=1��10-a mol?L-1 |
| B����K�㣬ˮ��Һ�д��ڣ�c��M+��=2c��A-�� |
| C����N�㣬ˮ��Һ�д��ڣ�c��M+��+c��H+��=c��A-��+c��OH-�� |
| D����K�㣬����ʱ��Һ��pH=10����c��MOH��+c��M+��=0.01mol?L-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com