
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
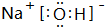 、
、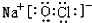 ,
,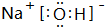 或
或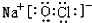 ;
;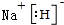 ,
,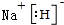 ;
;

 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、铝是地壳里含量最多的金属元素 |
| B、铝容易失去电子,表现还原性 |
| C、在空气中用酒精灯点不着 |
| D、在常温下,铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>戊>甲 |
| C、丙与庚的元素原子核外电子数相差13 |
| D、形成的最简单氢化物的稳定性:己>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
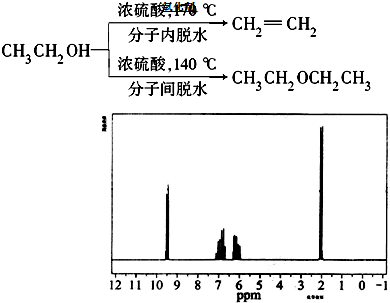
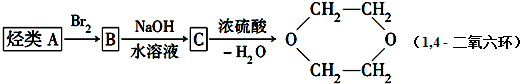
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ClO2 |
| B、Cl2O3 |
| C、Cl2O |
| D、Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com