
| 11.2L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |
|
| 4L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、H2O分子的价电子总数 |
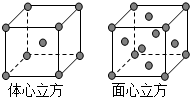
| B、在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 |
| C、金属钠的晶胞中钠原子的配位数 |
| D、氯化铯晶体中Cs+的配位数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
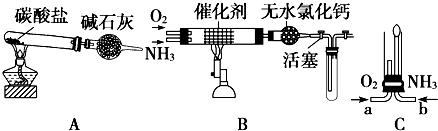
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或反应 | 原理解释 |
| A | 水在高温下难分解 | 水分子之间存在氢键 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | Al2O3熔点高于Al单质 |
| C | 将氯化银溶于水形成的悬浊液,向其中加入KI生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.48g |
| B、3.36g |
| C、3.25g |
| D、2.80g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaW+Z2═2NaZ+W2 |
| B、2NaX+Z2═2NaZ+X2 |
| C、2NaW+Y2═2NaY+W2 |
| D、2NaZ+X2═2NaX+Z2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com