
| A. | H2 D2 | B. | 14N 14C | C. | 16O 17O | D. | O2O3 |
科目:高中化学 来源: 题型:选择题
| A. | v(A)=9.0mol/(L•min) | B. | v(B)=0.6 mol/(L•s) | C. | v(C)=0.3 mol/(L•s) | D. | v(D)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
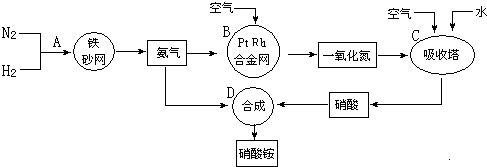
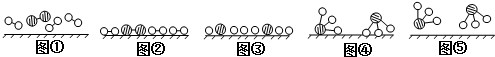
 、
、 、
、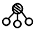 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
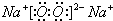 ;B的氢化物的结构式为
;B的氢化物的结构式为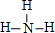 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素原子半径呈周期性变化 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子晶体 | 原子晶体 | 分子晶体 |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 | 苯 |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
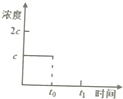 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.6×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B)=0.8mol/(L•s) | B. | v(A)=0.6mol/(L•s) | C. | v(C)=0.9mol/(L•s) | D. | v(B)=1.0mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com