Cu20是不溶于水的碱性物质,能溶于酸发生歧化反应,生成Cu和Cu2+.测Cu20在矿石中含量的方法为:将矿石溶于足量的Fe2(S04)和H2S04的混合溶液中,然后用KMn04测定.
(1)完成并配平下列化学方程式:□Cu2O+□Fe2(SO4)3+□H2SO4--□CuSO4+□FeSO4+□______.
(2)滴入KMnO4时发生反应的离子方程式为______.
(3)若每次测定中称取5.00g矿样,滴定时消耗O.10mol/LKMn04溶液100mL.通过计算确定矿样中Cu20的质量分数为______.
解:(1)该反应中,元素的化合价变化为:Cu
2O→CuSO
4,铜元素由+1价→+2价,一个Cu
2O失去2个电子;
Fe
2(SO
4)
3→FeSO
4,铁元素由+3价→+2价,一个Fe
2(SO
4)
3得2个电子,所以得失电子的最小公倍数为2,所以Cu
2O、Fe
2(SO
4)
3的计量数都为1,然后根据原子守恒配平,所以其方程式为Cu
2O+Fe
2(SO
4)
3+H
2SO
4═2CuSO
4+2FeSO
4+H
2O.
故答案为:Cu
2O+Fe
2(SO
4)
3+H
2SO
4═2CuSO
4+2FeSO
4+H
2O.
(2)KMnO
4有强氧化性,FeSO
4 有还原性,当溶液中滴加高锰酸钾后,高锰酸钾和硫酸亚铁发生氧化还原反应生成硫酸锰、硫酸铁和水,所以离子方程式为5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O.
故答案为:5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O.
(3)设矿样中氧化亚铜的质量为xg.
根据方程式Cu
2O+Fe
2(SO
4)
3+H
2SO
4═2CuSO
4+2FeSO
4+H
2O和5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O中得失电子数相等,得出氧化亚铜和高锰酸钾的关系式为5Cu
2O→2KMnO
4.
5Cu
2O→2KMnO
4 720g 2mol
xg O.10mol/L×0.1L
所以x=3.6
w%=
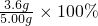
=72%
故答案为:72%.
分析:(1)根据氧化还原反应中得失电子数相等配平;
(2)根据高锰酸钾和硫酸亚铁的性质分析并写出离子方程式;
(3)根据高锰酸钾、硫酸亚铁和氧化亚铜之间的关系计算氧化亚铜的质量,然后根据质量分数公式计算其质量分数.
点评:本题考查了氧化还原反应的配平及有关计算,要依据氧化还原反应中得失电子数相等进行配平;明确氧化亚铜和高锰酸钾的关系式是解(3)题的关键,

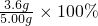 =72%
=72%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案