
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
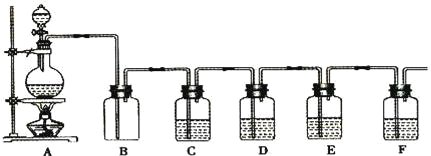
如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂所起的作用__。
【答案】C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 无水CuSO4 品红溶液 足量的酸性KMnO4溶液 品红溶液 澄清石灰水 检验SO2是否已被除尽
CO2↑+2SO2↑+2H2O 无水CuSO4 品红溶液 足量的酸性KMnO4溶液 品红溶液 澄清石灰水 检验SO2是否已被除尽
【解析】
浓硫酸和碳在加热的条件下发生反应生成二氧化碳、二氧化硫和水,应该首先检验产物中的水,以防后面的溶液对水的检验的干扰,为了防止二氧化硫对二氧化碳检验的干扰,在检验完水后再检验产物中的二氧化硫并将产物中的二氧化硫吸收完全,然后再检验二氧化碳的存在,根据题中装置、各气体的性质选择合适的药品,据此分析解答此题。
装置A中浓硫酸和碳在加热的条件下发生反应生成二氧化碳、二氧化硫和水,反应的方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;由分析可知先检验水,检验水用无水硫酸铜,无水硫酸铜变蓝证明有水,因此装置B中为无水硫酸铜;然后C中装有品红,通过观察品红是否褪色来检验二氧化硫的存在,为了防止二氧化硫对二氧化碳检验的干扰,D中用足量的酸性高锰酸钾溶液除去二氧化硫,在E中加入品红溶液来检验D中验SO2是否已被除尽,最后在F中用澄清的石灰水来检验二氧化碳。故答案依次为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;由分析可知先检验水,检验水用无水硫酸铜,无水硫酸铜变蓝证明有水,因此装置B中为无水硫酸铜;然后C中装有品红,通过观察品红是否褪色来检验二氧化硫的存在,为了防止二氧化硫对二氧化碳检验的干扰,D中用足量的酸性高锰酸钾溶液除去二氧化硫,在E中加入品红溶液来检验D中验SO2是否已被除尽,最后在F中用澄清的石灰水来检验二氧化碳。故答案依次为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;无水CuSO4;品红溶液;足量的酸性KMnO4溶液;品红溶液;澄清石灰水;检验SO2是否已被除尽。
CO2↑+2SO2↑+2H2O;无水CuSO4;品红溶液;足量的酸性KMnO4溶液;品红溶液;澄清石灰水;检验SO2是否已被除尽。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上,常采用氧化还原方法处理尾气中的CO、NO。
方法1:氧化法。沥青混凝土可作为反应:2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
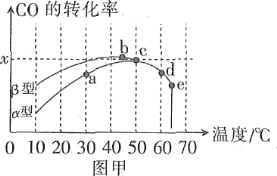
(1)在a、b、c、d四点中,未达到平衡状态的是____。
(2)已知c点时容器中O2浓度为0.04mol·L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____(用含x的代数式表示)。
(3)下列关于图甲的说法正确的是____。
A.CO转化反应的平衡常数K(a)<K(c)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
方法2:还原法。某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图乙所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(4)375℃时,测得排出的气体中含0.45molO2和0.052molCO2,则Y的化学式为____。
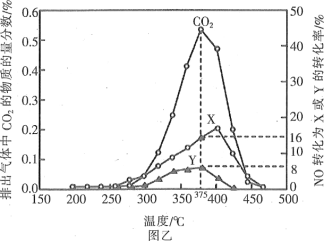
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有5molKNO3和2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A.所得溶液中c(NO3-)=2.75mol·L-1
B.所得溶液中c(Fe2+):c(Fe3+)=1:1
C.反应后生成NO的体积为33.6L(标准状况下)
D.所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③实验②生成的溶液滴在KI试纸上,试纸变蓝
下列判断正确的是( )
A.上述实验证明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中共有两个氧化还原反应
C.实验①生成的气体不能使湿润的KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
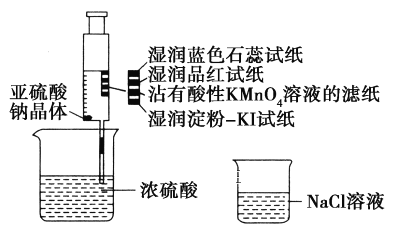
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
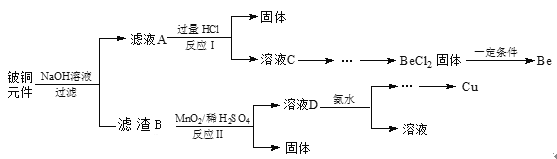
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似。
(1)氢氧化铍的电离方程式为____。
(2)滤液A的主要成分除NaOH外,还有____(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程____。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序_____。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是_____。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式______。
②若用浓HNO3溶解金属硫化物,缺点是______(任写一条)。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体粉末,可能由Na2CO3、Na2SO4、CuSO4、NH4Cl中的一种或几种组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加氯化钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀盐酸中,发现沉淀不溶解。
(1)试判断:固体混合物中肯定含有____________________,生成白色沉淀的化学方程式______________________________________;肯定没有_____________________________;可能含有________________________
(2)检验是否含有可能存在的物质的实验方法是:________化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com