
����Ŀ����ͭ����ѧ����ѧ�ۺ��������õĺϽ𣬹㷺Ӧ�������������Ԫ���������Ǵ�ij�Ͼ���ͭԪ��(��BeO25%��CuS71%������FeS��SiO2)�л������ͭ���ֽ��������̡�
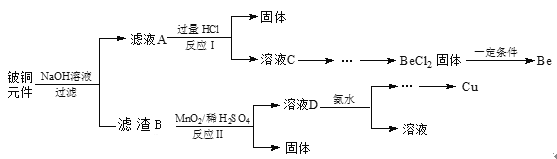
��֪��I���롢��Ԫ�ش������ڱ��еĶԽ���λ�ã���ѧ�������ơ�
��1����������ĵ��뷽��ʽΪ____��
��2����ҺA����Ҫ�ɷֳ�NaOH�⣬����____(�ѧʽ)��д����ӦI�к��뻯������������ᷴӦ�����ӷ���____��
��3������ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2��ѡ��������貢����_____��
a����������� NaOH b��ͨ�������CO2 c����������İ�ˮ
d������������HCl e������ f��ϴ��
�ڴ�BeCl2��Һ�еõ�BeCl2����IJ�����_____��
��4����MnO2�ܽ����������е���Ԫ������Ϊ������д����Ӧ����CuS������Ӧ�Ļ�ѧ����ʽ______��
������ŨHNO3�ܽ�������ȱ����______(��дһ��)��
��5��ȡ��ͭԪ��1000g�����ջ��Be������Ϊ81g���������______��
���𰸡�2H++BeO22-![]() Be(OH)2
Be(OH)2![]() Be2++2OH- Na2SiO3��Na2BeO2 BeO22-+4H+=Be2++2H2O cefd ���Ȼ���������������ᾧ MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O ������Ⱦ���������� 90%
Be2++2OH- Na2SiO3��Na2BeO2 BeO22-+4H+=Be2++2H2O cefd ���Ȼ���������������ᾧ MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O ������Ⱦ���������� 90%
��������
�Ͼ���ͭԪ��(��BeO��25%��CuS��71%������FeS��SiO2)��������������Һ���˵õ���ҺAΪNaOH��Na2SiO3��Na2BeO2����ҺA�м������������˵õ�����Ϊ���ᣬ��ҺC��ҪΪ��NaCl��BeCl2������HCl����������İ�ˮ���ˣ�ϴ�Ӽ���������HCl �õ��Ȼ�����Һ������Ũ����ȴ�ᾧ�õ����壬һ�������·�Ӧ�õ��룬����B�м���������̵�ϡ���ᷢ����ӦMnO2�ܽ����������е���Ԫ������Ϊ���ʣ����˵õ��������ҺD����ҺD�к�c(Cu2+)��c(Fe3+)��c(Mn2+)����μ���ϡ��ˮ����pH�����η��룬���һϵ�в����õ�ͭ��
(1)��������������ԣ��ɵ����OH-��Ҳ���Ե����H+��������뷽��ʽΪ2H++BeO22-![]() Be(OH)2
Be(OH)2![]() Be2++2OH-��
Be2++2OH-��
(2)������֪����ҺA����Ҫ�ɷֳ�NaOH�⣬���У�Na2SiO3��Na2BeO2����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽΪ��BeO22-+4H+=Be2++2H2O��
(3)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2��ѡ�����������˳��Ϊ����������İ�ˮ���ˣ�ϴ�Ӽ���������HCl��˳��Ϊ��cefd���ʴ�Ϊ��cefd��
�ڴ�BeCl2��Һ�еõ�BeCl2����ʱΪ������Be2+���ӵ�ˮ�⣬��Ҫ��HCl�����ж�BeCl2��Һ�����ᾧ��
(4)��MnO2�ܽ����������е���Ԫ������Ϊ���ʣ���ӦII��CuS������Ӧ�Ļ�ѧ����ʽΪ��MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O��
��Ũ�������������������������ԭΪ����������NO2�����ж���Ⱦ������
(5)�������BeO����=1000��25%=250g�������ϵõ�Be�����ʵ���=![]() =10mol��ʵ�ʵõ�Be���ʵ���=
=10mol��ʵ�ʵõ�Be���ʵ���=![]() =9mol������=
=9mol������=![]() ��100%=90%��
��100%=90%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ������ͼ������˵��������ǣ� ��

A.X��Y��Ӧ�ļ��⻯��ĵ�������ͬB.W������������Ӧˮ��������Ա�Q��ǿ
C.X��Z����������ϼ�֮�͵���ֵ����8D.![]() ��
��![]() �ĺ���������͵��Ӳ�������ͬ
�ĺ���������͵��Ӳ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ������ͼ��ʾʵ��װ�ý���ijЩ������Ʊ������ʵ�ʵ��(ͼ�мг�װ����ʡ��)���밴Ҫ����գ�


��.̽�������백���ķ�Ӧ
��1��Ϊ��ȡ���ﰱ�����ɽ�װ��C��___(��װ������)���ӣ�װ��C�е���ƿ�ڹ�����ѡ��___��
a.�Ȼ��� b.��ʯ�� c.���������� d.��ʯ��
��2��װ��A��E��E���ӿ���ȡ�����������������������Eװ���ڵ�ҩƷ������__��
��3��װ��F������̽�������백���ķ�Ӧ��ʵ��ʱ����1��3���ر�2��������ƿ��ͨ��___�������ƣ���Ȼ��ر�1��3����2������ƿ�л���ͨ��һ��������һ�����塣ʵ��һ��ʱ�����ƿ�ڳ���Ũ��İ��̲��������ڱ����ᣬ�����һ��ʵ�鷽�������ù����е�������___��F���ձ�����װҺ��Ϊ__�������������__��
��.̽��ijЩ���ʵ�����
��1������װ��A��E�������ʵ��Ƚ�Cl-��Br-�Ļ�ԭ��ǿ������װ��A�в���������ͨ��ʢ��NaBr��Һ��װ��E�У���ַ�Ӧ��ȡ��E������CCl4�����ú�۲쵽____��ʵ��������֤��Br-�Ļ�ԭ��ǿ��Cl-��
��2����װ��B��C�ֱ���F��������H2S��SO2��Ӧ��ʵ�顣�������װ��B�����ԵIJ���____��F����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�Ǻϳ��������������в���������������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·��:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
![]() + Cu(OH)2
+ Cu(OH)2![]()
![]() +H2O
+H2O
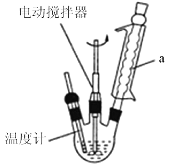
�Ʊ��������װ��ʾ��ͼ��ͼ(���Ⱥͼг�װ�õ���)��
��֪: ��������۵�Ϊ76.5�棬����������������ˮ��������ˮ�������Ҵ���
��ش���������:
��1����װ���е���Һ������100�棬�����μ�40g �����浽������Һ�У�Ȼ��������130�������Ӧ����װ��ʾ��ͼ�У�����a��������________����������_____________��
��2����Ӧ�������������ˮ���ɷ�����������Ʒ���������ˮ��Ŀ����____________�����������п����ڷ��뱽�����Ʒ����_______(����)��
A.��Һ©�� B.©�� C.�ձ� D.ֱ�������� E.������
��3�����Ҫ���������Ʒ��һ���ᴿ����ѡ���ʵ�鷽����___________(����ַ���)��
��4����CuCl2��2H2O��NaOH ��Һ�Ʊ�����Cu(OH)2�����������������ˮϴ�ӳ������жϳ���ϴ�ɾ���ʵ�������������____________��
��5������������뵽�Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu(OH)2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ���������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧʵ���г������Ʊ����岢����ijЩ���ʵļ��������ʵ���װ�ã�A���Ʊ������װ�ã�C��D��E��F��ʢװ��Һ�������ͬ��Ҳ���ܲ�ͬ���Իش�
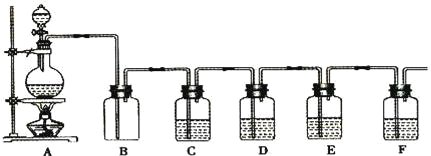
���A�еĹ���������̼����Һ©����ʢװ����Ũ���ᣬ��д�������Ļ�ѧ��Ӧ����ʽ��____����Ҫ�������ɵIJ����B��C��D��E��F��Ӧ�ֱ������Լ�Ϊ__��__��__��__��__��E���Լ����������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���pH��Ϊ11�������ΪV0��AOH��BOH��Һ���ֱ��ˮϡ�������V��pH��lg ![]() �ı仯��ͼ��ʾ������˵������ȷ����
�ı仯��ͼ��ʾ������˵������ȷ����

A. ����ǿ����AOH��BOH
B. ˮ�ĵ���̶ȣ�a=b��c
C. ϡ����ͬ����ʱ��c��A+����c��B+��
D. ������������a=b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£��ڸ������ƿ�г���������NH3��������ͼ��ʾ����Ȫʵ�飬����˵���������
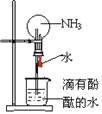
A.��ʵ��֮�����ܹ�������Ȫ����Ϊ������������ˮ��������ƿ�������ѹǿ��
B.����ƿ�İ����л�����������������Ȫʵ����ˮ���ܳ�����ƿ
C.��ʵ������NH3����HCl��Ҳ�ܲ�����ɫ����Ȫ
D.ʵ���������ƿ�а�ˮ�����ʵ���Ũ��Ϊ![]() mol/L��
mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ڲ�ͬ�¶��·ֽ���в�ͬ�IJ����Ӧ����ʽ���£�
��NH4NO3![]() NH3��+HNO3����NH4NO3
NH3��+HNO3����NH4NO3![]() N2O��+2H2O��
N2O��+2H2O��
��2NH4NO3![]() 2N2��+O2��+4X����4NH4NO3
2N2��+O2��+4X����4NH4NO3![]() 3N2��+2NO2��+8H2O��
3N2��+2NO2��+8H2O��
��ش��������⣺
��1�����ĸ���Ӧ������������ԭ��Ӧ����___����
��2����Ӧ��������X�Ļ�ѧʽ��___��
��3����Ӧ������������ͻ�ԭ����������___��___�����ѧʽ��
��4������Ӧ�����ɱ�״���µ�11.2L��������ת�Ƶ�����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ĺ�ҵԭ�ϡ�
��1����ҵ�ϳ��ù�����ˮ���ն������÷�Ӧ�Ļ�ѧ����ʽΪ____��
��2�����������ǹ�ҵ�����кϳ��������Ҫ;�����ϳɵĵ�һ���ǽ����Ϳ����Ļ����ͨ�����ȵIJ���Ͻ������ںϽ����Ĵ��£�����������һ���������÷�Ӧ�Ļ�ѧ����ʽΪ____��
���з�Ӧ�еİ��백�������еİ�������ͬ����___��
A��2Na+2NH3=2NaNH2+H2�� B��2NH3+3CuO=3Cu+N2+3H2O
C��4NH3+6NO=5N2+6H2O D��HNO3+NH3=NH4NO3
��ҵ�е�β��������ֻ��NO��NO2�����ռ�������գ���Ӧ�����ӷ���ʽΪ2NO2+2OH��=NO2-+NO3-+H2O��NO+NO2+2OH��=___+H2O����ƽ�÷���ʽ����
��3����27.2gCu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡHNO3500mL����Ӧ�����в���������ֻ��NO��������ȫ�ܽ����������Һ������������ֻ��Cu2+���м���1L1mol��L-1��NaOH��Һʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2g��
��Cu��ϡHNO3��Ӧ�����ӷ���ʽΪ________��
��Cu��Cu2O �����ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com