
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
【答案】SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3] 4NH3+5O2![]() 4NO+6H2O BC 2NO2- 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 2∶1
4NO+6H2O BC 2NO2- 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 2∶1
【解析】
(1)二氧化硫与氨气反应生成亚硫酸铵;
(2)氨催化氧化生成一氧化氮和水,反应中氨气是还原剂;根据质量守恒和得失电子守恒配平;
(3)①Cu与稀HNO3反应生成硝酸铜、一氧化氮和水,据此书写反应的离子反应方程式;②根据氢氧化钠计算出生成的氢氧化铜的物质的量,再根据铜元素守恒列式计算。
(1)二氧化硫与过量氨气反应生成亚硫酸铵,反应的化学方程式为:SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3],故答案为:SO2+2NH3H2O=(NH4)2SO3+H2O[或SO2+2NH3+H2O=(NH4)2SO3];
(2)氨催化氧化生成一氧化氮和水,反应方程式为:4NH3+5O2 ![]() 4NO+6H2O,反应中氨气是还原剂,显示氨气的还原性。
4NO+6H2O,反应中氨气是还原剂,显示氨气的还原性。
A.反应2Na+2NH3=2NaNH2+H2↑中,氨气是氧化剂,故A不选;B.反应2NH3+3CuO=3Cu+N2+3H2O中,氨气是还原剂,故B选;C.反应4NH3+6NO=5N2+6H2O中,氨气是还原剂,故C选;D.反应HNO3+NH3=NH4NO3是非氧化还原反应,故D不选;与4NH3+5O2 ![]() 4NO+6H2O中的氨作用相同的是BC;由质量守恒和得失电子守恒,配平为:NO+NO2+2OH-=2NO2-+H2O,故答案为:4NH3+5O2
4NO+6H2O中的氨作用相同的是BC;由质量守恒和得失电子守恒,配平为:NO+NO2+2OH-=2NO2-+H2O,故答案为:4NH3+5O2 ![]() 4NO+6H2O;BC;2NO2-;
4NO+6H2O;BC;2NO2-;
(3)①Cu与稀HNO3反应生成硝酸铜、一氧化氮和水,离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀为Cu(OH)2,质量为39.2g,物质的量为![]() =0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,设Cu、Cu2O的物质的量分别为x、y,则64x+144y=27.2,x+2y=0.4,解得x=0.2,y=0.1,所以Cu与Cu2O 的物质的量之比为2∶1,故答案为:2∶1。
=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,设Cu、Cu2O的物质的量分别为x、y,则64x+144y=27.2,x+2y=0.4,解得x=0.2,y=0.1,所以Cu与Cu2O 的物质的量之比为2∶1,故答案为:2∶1。


科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
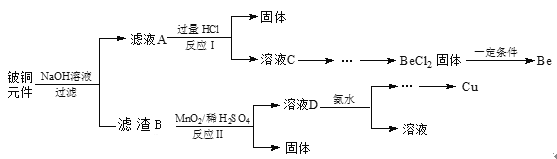
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似。
(1)氢氧化铍的电离方程式为____。
(2)滤液A的主要成分除NaOH外,还有____(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程____。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序_____。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是_____。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式______。
②若用浓HNO3溶解金属硫化物,缺点是______(任写一条)。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
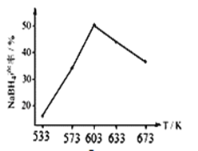
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
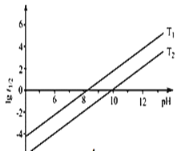
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构______________
(2)请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体:________ 黄绿色固体:________
(3)淡黄色固体物质是由________分子组成,黄绿色固体物质是由_______分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积不变的密闭容器中进行如下可逆反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g),下列能表明该反应已达到化学平衡状态的是
①v正(SiF4)=4v逆(HF)②HF的体积分数不再变化③容器内气体压强不再变化
④混合气体的密度保持不变⑤4molO—H键断裂的同时,有2molH—F键断裂
A.①②③④B.②③④C.②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L己烷中含有碳原子的数目为6NA
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置__________;
(2)写出一种由a、c、d所形成的离子化合物__________ (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是_____________________;
(3)c的单质的电子式为__________。
(4)b和d相比,非金属性较强的是__________ (用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到平衡状态的是( )
A.CO全部转化为乙醇
B.反应体系中乙醇的物质的量浓度不再变化
C.正反应和逆反应的化学反应速率均为零
D.CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com