
 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。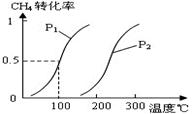
 _。
_。 CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。 △H_ _0,△S_ _0(填“<”、“>”或“=”)。
△H_ _0,△S_ _0(填“<”、“>”或“=”)。| l 实验编号 | l T(℃) | l n (CO)/n(H2) | l P(MPa) |
| l ⅰ | l 150 | l 1/3 | l 0.1 |
| l ⅱ | l _ _ | l _ _ | l 5 |
| l ⅲ | l 350 | l _ _ | l 5 |

 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:不详 题型:单选题
 H2(g)+Br2(g)-Q,若升高温度,发生改变的是 ( )
H2(g)+Br2(g)-Q,若升高温度,发生改变的是 ( )| A.分子数 | B.压强 | C.密度 | D.平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4C(g)+D(s),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
4C(g)+D(s),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( ) | A.4 mol A+2 mol B | B.4 mol C+1 mol D+2mol A+1 mol B |
| C.4 mol C+1.5 mol D | D.4 mol C+0.8mol D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
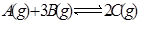 达到平衡的标志的是( )
达到平衡的标志的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a、b、c、d四个点中,只有b点的化学反应处于平衡状态 |
| B.前10 min内用υ(NO2)表示的化学反应速率为0.04 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是升高温度 |
| D.a点,用υ(NO2)表示的化学反应速率等于用υ(N2O4)表示的化学反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
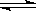 2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。
2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中NH3的体积是0.1 V L。| A.原混合气体的体积为1.2V L | B.原混合气体的体积为1.1VL |
| C.反应达平衡时N2消耗掉0.05 V L | D.反应达平衡时H2消耗掉0.5 V L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
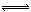 NH3(g)+H2S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是
NH3(g)+H2S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是| A.其他条件不变时通入SO2气体 |
| B.移走一部分NH4HS固体 |
| C.容器体积不变,充入N2 |
| D.压强不变时,充入N2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g) + qD(g)的平衡常数为K,下列说法正确的是
pC(g) + qD(g)的平衡常数为K,下列说法正确的是| A.平衡常数发生变化,化学平衡必发生移动 |
| B.化学平衡发生移动,平衡常数必发生变化 |
| C.反应物的转化率越大,达到平衡时,K值越大 |
| D.温度越高,达到平衡时,K值越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol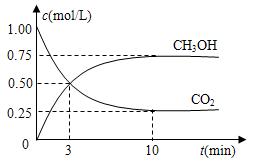
A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com