
 pC(g) + qD(g)的平衡常数为K,下列说法正确的是
pC(g) + qD(g)的平衡常数为K,下列说法正确的是| A.平衡常数发生变化,化学平衡必发生移动 |
| B.化学平衡发生移动,平衡常数必发生变化 |
| C.反应物的转化率越大,达到平衡时,K值越大 |
| D.温度越高,达到平衡时,K值越大 |
科目:高中化学 来源:不详 题型:填空题
 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。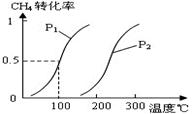
 _。
_。 CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。 △H_ _0,△S_ _0(填“<”、“>”或“=”)。
△H_ _0,△S_ _0(填“<”、“>”或“=”)。| l 实验编号 | l T(℃) | l n (CO)/n(H2) | l P(MPa) |
| l ⅰ | l 150 | l 1/3 | l 0.1 |
| l ⅱ | l _ _ | l _ _ | l 5 |
| l ⅲ | l 350 | l _ _ | l 5 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
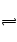 10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]="2.35" ×10-59, Ksp[Ca10(PO4)6F2]=7.1× 10-61,Ksp[CaCO3]="5" ×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是( )
10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]="2.35" ×10-59, Ksp[Ca10(PO4)6F2]=7.1× 10-61,Ksp[CaCO3]="5" ×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是( )| A.口腔内残留食物会发酵使口腔呈酸性,所以饭后、睡前应该要漱口 |
| B.饮用水中氟元素含量较低的地区使用含氟牙膏可有效防止龋齿 |
| C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,后者c(Ca2+)较大 |
| D.25℃时,在CaCO3悬浊液中加入NaF溶液后,CaCO3不可能转化为CaF2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H2(g)+Br2(g) 2HBr(g)ΔH<0 2HBr(g)ΔH<0 |
B.N2(g)+3H2(g) 2NH3(g)ΔH<0 2NH3(g)ΔH<0 |
C.A(s) B(s)+ C(g)ΔH>0 B(s)+ C(g)ΔH>0 |
D.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH<0 4NO(g)+6H2O(g)ΔH<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.氯水中有平衡:Cl2+H2O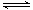 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅。 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅。 |
B.对CO(g)+NO2(g)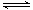 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 |
| C.升高温度能够促进水的电离 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是( )
SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是( )| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1 mol SO3的同时生成1 mol NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g);ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
2SO3(g);ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )| A.第一次平衡时反应放出的热量为294.9 kJ |
| B.两次平衡SO2的转化率相等 |
| C.第二次达平衡时SO3的体积分数大于 |
| D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 特列原理。请回答下列问题。
特列原理。请回答下列问题。 4C(g)
4C(g)  H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 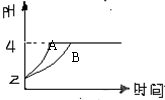
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com