
| A. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| B. | C的单质在点燃条件分别与A、B、D的单质化合,所得化合物均存在共价键 | |
| C. | 四种元素的单质中,熔沸点最高的是D的单质 | |
| D. | C和D所形成离子的电子层结构一定相同 |
分析 0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素,结合对应单质、化合物的性质以及题目要求可解答该题.
解答 解:0.1 mol/L 丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+辛,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,辛是由C组成的单质,由发生反应可知,辛不能是Na,结合原子数可知,A为H、C为O、D为Na元素,故辛为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+辛,可知丙是二氧化碳,戊是碳酸钠,则B为碳元素.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径大小顺序为:Na>C>O,即:D>B>C,故A错误;
B.氧气与氢气、碳反应生成化合物只含有共价键,氧气与Na在加热条件下反应生成过氧化钠,含有离子键、共价键,故B正确;
C.四种元素的单质中,氢气、氧气为气体,Na的熔沸点较低,而碳元素可以形成原子晶体,其沸点最高,故C错误;
D.C元素可以形成O22-离子,与钠离子电子层结构不同,故D错误,
故选B.
点评 本题考查元素化合物推断,题目难度中等,需要学生熟练掌握元素化合物知识,对学生的逻辑推理有一定的要求.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
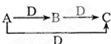 ,则A、D可能是( )
,则A、D可能是( )| A. | ①②③ | B. | ④⑤ | C. | ①②④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ②④⑤ | C. | ② | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4NA个离子的固体Na2O溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 | |
| B. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2一+O2+2H2O═2S↓+4OH- | |
| C. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3 | |
| D. | 滴加KSCN显红色的溶液中存在:NH4+、K+、C1-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是混合物,其分馏产品汽油是纯净物 | |
| B. | 焰色反应有特征颜色出现,所以是化学反应 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 大量化石燃料是造成雾霾天气的一种重要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com