
| A. | 含4NA个离子的固体Na2O溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 | |
| B. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2一+O2+2H2O═2S↓+4OH- | |
| C. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3 | |
| D. | 滴加KSCN显红色的溶液中存在:NH4+、K+、C1-、I- |
分析 A.1mol氧化钠含有3mol离子,结合n=$\frac{N}{{N}_{A}}$计算氧化钠的物质的量,氧化钠溶于水生成NaOH,根据钠离子守恒结合c=$\frac{n}{V}$计算;
B.硫离子被氧气氧化生成硫,结合电荷守恒可知,有氢氧根离子守恒,配平书写离子方程式判断;
C.碳酸钠、碳酸氢钠均与氢氧化钙反应得到碳酸钙沉淀;
D.滴加KSCN显红色的溶液中存在铁离子,铁离子具有强氧化性,可以氧化I-.
解答 解:A.1mol氧化钠含有3mol离子,氧化钠的物质的量$\frac{4{N}_{A}}{{N}_{A}mo{l}^{-1}}$×$\frac{1}{3}$=$\frac{4}{3}$mol,氧化钠溶于水生成NaOH,根据钠离子守恒,溶液中钠离子物质的量为$\frac{4}{3}$mol×2=$\frac{8}{3}$mol,故钠离子浓度为$\frac{\frac{8}{3}mol}{1L}$=$\frac{8}{3}$mol/L,故A错误;
B.硫离子被氧气氧化生成硫,结合电荷守恒可知,有氢氧根离子守恒,配平后离子方程式为:2S2-+O2+2H2O═2S↓+4OH-,故B正确;
C.碳酸钠、碳酸氢钠均与氢氧化钙反应得到碳酸钙沉淀,无法鉴别,故C错误;
D.滴加KSCN显红色的溶液中存在铁离子,铁离子具有强氧化性,可以氧化I-,不能与碘离子大量共存,故D错误,
故选B.
点评 本题考查物质的量浓度计算、离子方程式、物质检验、离子共存,是对学生综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的物理性质相同、化学性质不相同 | |
| B. | 通过化学反应可实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间相互转化 | |
| C. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的原子核外电子排布的方式不相同 | |
| D. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O能形成三种化学性质相同的氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe2++Fe3++4H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 溶液中FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | 元素周期表中核电荷数最小的元素 |
| y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾可能是许多组小液体和固体微粒分散到空气中形成的一种气溶胶 | |
| B. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| C. | 含磷合成洗涤剂易被细菌分解,故不会导致水体污染 | |
| D. | 大量使用风能、太阳能、符合“低碳”概念 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B) | |
| B. | C的单质在点燃条件分别与A、B、D的单质化合,所得化合物均存在共价键 | |
| C. | 四种元素的单质中,熔沸点最高的是D的单质 | |
| D. | C和D所形成离子的电子层结构一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1 mol/L-1 CH3COOH溶液 | pH=3 CH3COOH 溶液 | 0.1 mol/L-1 NaOH溶液 | pH=11 NaOH溶液 |
| A. | 由水电离出的c(H+):③>① | |
| B. | ①稀释到原来的100倍后,pH与②相同 | |
| C. | ①与③混合,若溶液pH=7,则两溶液的体积:③>① | |
| D. | ②与④混合,若溶液pH=7,则两溶液的体积:④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
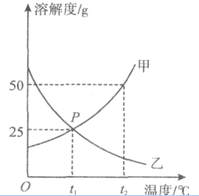 如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com