
【题目】量取16.0mL 10.0molL﹣1HCl溶液,加蒸馏水稀释至100mL,取两份稀释后的HCl溶液各25mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积),请计算:

(1)稀释后HCl溶液的物质的量浓度为 mol·L-1。
(2)加入Al的质量至少有 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在有机溶剂里使3 mol PCl5 与 3molNH4Cl定量地发生完全反应,释放出12mol的HCl,同时得到一种白色固体A 1mol;A的熔点为113℃,在减压下50℃即可升华。
(1)PCl5分子中磷原子和氯原子是否均达到8电子稳定结构? (选填“是”或“否”)
(2)固体A的相对分子质量为 。
(3)分子结构测定实验表明,A分子结构中N、P原子组成六元环,且满足P五价,N三价,Cl一价(此处的“价”指成键时共用电子对数目)。画出A的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸。反应方程式如下:
![]() +2KMnO4
+2KMnO4![]()
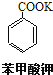 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
已知有关化合物的相关数据如表所示:
化合物 | 相对分子质量 | 密度(g/cm3) | 溶解性 | 沸点(℃) |
甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
苯甲酸钾 | 160 | — | 易溶于水 | — |
苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
苯甲酸在100g水中的溶解度0.18g(4℃),0.27g(18℃),2.2g(75℃)。
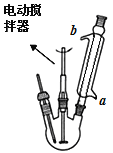
合成:如上图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾。经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物。
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤。
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④_________→⑤过滤→⑥洗涤→⑦干燥。
请回答下列问题:
(1)实验室中量取4.23mL甲苯所需仪器为_________。
(2)冷凝管的上口是否需要塞上塞子________(填“是”或“否”),a处水流方向是_______(填“进水”或“出水”)。
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由_________。
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是_________;“④”的操作名称是________;可证明“⑥洗涤”步骤已洗涤干净的方法是_____________。
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
丁二酮肟![]() 是检验Ni2+的灵敏试剂。
是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为 。丁二酮肟分子中C原子轨道杂类型为 ,1mol丁二酮肟分子所含![]() 键的数目为 。
键的数目为 。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。
①Ni(CO)4固态时属于 晶体(填晶体类型)。
②与CO互为等电子体的阴离子为 (填化学式)。
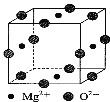
(3)Ni2+与Mg2+、O2—形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
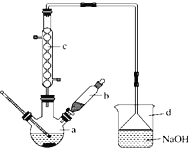
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如下表,请按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/gcm3 | 0.88 | 3.10 | 1.50 |
沸点/C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。 向a中滴入几滴溴,有白色烟雾产生,是因为生成了______气体。继续滴加至液溴滴完。装置d的作用是_________;
(2) 液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH 溶液洗涤的作用是___________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____________________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______;(填入正确选项前的字母)
A.重结晶 B. 过滤 C. 蒸馏 D. 萃取
(4)在该实验中,a的容积最适合的是______.(填入正确选项前的字母)
A. 25mL B. 50mL C. 250mL D. 500mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时10ml某气态烃与过量氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到室温,气体体积减少了30ml,剩余气体再通过苛性钠溶液,体积又减少了30ml。求气态烃的分子式及结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】利用天然气合成氨的工艺流程示意如下,完成下列填空:
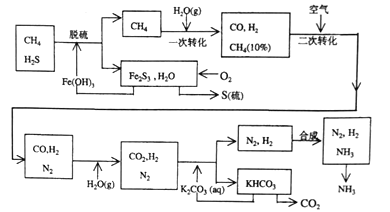
(1)天然气脱硫采用了Fe(OH)3,Fe(OH)3可以再生循环,可以再生循环.写出上述工艺中由Fe2S3再生Fe(OH)3的化学方程式是 。含硫化合物遇到Fe3+的反应情况与反应条件有关.以NaHS溶液与FeCl3溶液混合为例:将溶液置于80°C的热水浴中,发现有红褐色沉淀生成,写出该反应的化学方程式: 。解释该反应在温度升高后能发生,而低温时不易发生的原因 。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2___mol(用含n的代数式表示)
(3)K2CO3和CO2又反应在加压下进行.加压的理论依据是 (多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.艘喊中和原理
(4)整个流程有兰处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,还有一处循环未标明.请指出上述流程图中第三处循环的物质是 ·
(5)工业上制取的硝酸铵的流程图如下.请回答下列问题:
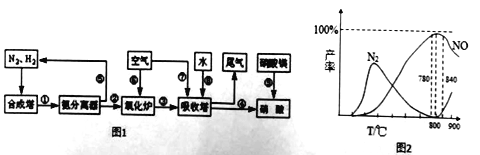
据图2可知工业上氨催化氧生成NO时.应该控制温度在 左右.其中在吸收塔中为了尽可能提高硝酸的产率,减少尾气排放.常常调节空气与NO的比例.写出吸收塔内发生反应的总化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com