
【题目】实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是
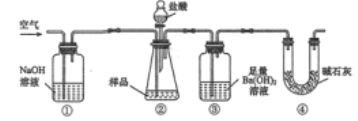
A. 实验前, 应进行气密性检查
B. 必须在装置②、 ③间添加吸收 HCl 气体的装置
C. 装置④的作用是防止空气中的 CO2进入装置③与 Ba(OH)2 溶液反应
D. 反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为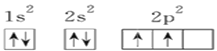
D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以完成的实验组合是
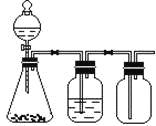
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
【答案】B
【解析】
A. 二氧化锰与氯酸钾制取氧气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项A错误;
B.大理石与盐酸生成二氧化碳气体,属于固液常温型,盐酸有挥发性,挥发的HCl能与碳酸氢钠溶液反应产生二氧化碳气体,且二氧化碳密度比空气的大,能用向上排空气法收集;选项B正确。
C.锌粒与稀硫酸反应生成氢气,属于固液常温型,但氢气密度比空气的小,不能用向下排空气法收集,选项C错误;
D. 二氧化锰与浓盐酸制取氯气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项D错误;
故合理选项是B。
【题型】单选题
【结束】
20
【题目】下列物质中,不可作漂白剂的是( )
A. SO2 B. Ca(ClO)2 C. Na2SiO3 D. NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施可以提高燃料燃烧效率的是( )
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入大大过量的空气
A.①③B.①②③C.①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.9克的镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的氢氧化钠溶液,若要生成沉淀最多,加入这种氢氧化钠溶液的体积是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应 COCl2(g)![]() CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①已知:Cl元素在元素周期表中的位置可以描述为:第3行第17列,请用相同的形式描述Cr元素在元素周期表中的位置______________________。
②COCl2分子中所有原子均满足8电子构型,中心原子的杂化方式为________。COCl2分子中Cl—C—Cl之间的夹角______Cl—C—O之间的夹角(填“>”、“<”或“=”)。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
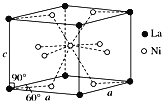
①该晶体的化学式为________________。
②已知该物质的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________nm3(用含M、d、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com