
【题目】下列措施可以提高燃料燃烧效率的是( )
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入大大过量的空气
A.①③B.①②③C.①③④D.全部
科目:高中化学 来源: 题型:
【题目】对于反应3S+6KOH ![]() 2K2S+K2SO3+3H2O,下列说法正确的是
2K2S+K2SO3+3H2O,下列说法正确的是
A. S是氧化剂,KOH是还原剂 B. 若3mol硫完全反应,则反应中共转移了4mol电子 C. 还原剂与氧化剂的质量比是2:1 D. 氧化产物和还原产物的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列关于该装置的四种说法,正确的组合是

①.a为直流电源的负极
②.阴极的电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O
③.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
④.电解时,H+由阴极室通过阳离子交换膜到阳极室
A. ①和② B. ①和③
C. ②和③ D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是
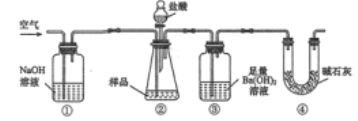
A. 实验前, 应进行气密性检查
B. 必须在装置②、 ③间添加吸收 HCl 气体的装置
C. 装置④的作用是防止空气中的 CO2进入装置③与 Ba(OH)2 溶液反应
D. 反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. A、 B、 C、 D、 E 均为中学化学常见的纯净物, B 为最常见液体,它们之间有如下的反应关系:
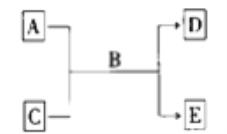
(1)若 A 为短周期的金属单质, D 为气态单质, 0.1 mol· L-1 C 溶液的 pH=13,则该反应的离子方程式为_______________________________________。
(2)若 A 的溶液能使淀粉溶液变蓝, C 为非金属氧化物, 且能使品红溶液褪色, 则该反应的化学方程式为_______________________________________。
(3)若 A、 C、 D、 E 均为化合物, E 为白色胶状沉淀,且 A、 C、 E 均含有同一种元素, 则该反应的离子方程式为_____________________________________。
(4)若单质 A 是良好的半导体材料,请写出工业上制取单质 A 粗品的化学方程式为________________________。
II.(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由 KClO3 在 H2SO4存在下与Na2SO3 反应制得。请写出该反应的离子方程式___________________________________________________________________。
(6)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为 Na2CO3·3H2O2,它具有 Na2CO3和 H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是______ (填字母)。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为: ___________ 。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式: V2O5 + Al ==== Al2O3 + V_____________
该反应中氧化剂是_____________ ,要得到1mol金属钒,需要纯铝的质量__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置探究氯气能否与水发生反应。已知气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:
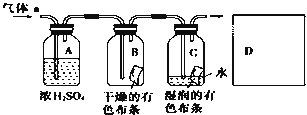
(1)浓硫酸的作用是_____________________________________。
(2)写出实验室制取Cl2的化学方程式_______________________________。
(3)证明氯气和水发生反应的实验现象为___________________________。
(4)该实验设计存在的缺陷是________,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
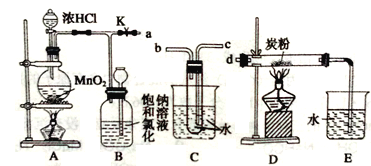
(1)A中盛放浓盐酸的仪器的名称是______________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是__________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
II、某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)漂白粉将在U型管中产生,其化学反应方程式是___________。
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:

①温度较高时氯气与消石灰反应生成了Ca(C1O3)2,为避免此副反应的发生,可采取的措施是___________________。
②试判断另一个副反应是(写出此反应方程式)____________,为避免此副反应发生,可采取的措施是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com