
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为: ___________ 。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式: V2O5 + Al ==== Al2O3 + V_____________
该反应中氧化剂是_____________ ,要得到1mol金属钒,需要纯铝的质量__________g。
【答案】2 Al +Fe2O3![]() Al2O3+2Fe 3 V2O5+ 10Al === 5 Al2O3+ 6 V V2O5 45
Al2O3+2Fe 3 V2O5+ 10Al === 5 Al2O3+ 6 V V2O5 45
【解析】
本题考查铝热反应,氧化还原反应方程式的配平,以及化学计算,(1)利用铝的金属性强于铁,铝与氧化铁发生反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe;(2)Al的化合价由0→+3价,V2O5中V的价态为+5价,转化为0价,V2O5中V共降低10价,最小公倍数为30,即化学反应方程式为3V2O5+10Al=5Al2O5+6V;氧化剂是化合价降低的物质,即氧化剂为V2O5,根据化学反应方程式,生成1molV,需要消耗金属铝的物质的量为10/6mol=5/3mol,其质量为5×27/3g=45g。
Al2O3+2Fe;(2)Al的化合价由0→+3价,V2O5中V的价态为+5价,转化为0价,V2O5中V共降低10价,最小公倍数为30,即化学反应方程式为3V2O5+10Al=5Al2O5+6V;氧化剂是化合价降低的物质,即氧化剂为V2O5,根据化学反应方程式,生成1molV,需要消耗金属铝的物质的量为10/6mol=5/3mol,其质量为5×27/3g=45g。


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)配平下列离子方程式:______
Ce3++ H2O2+ H2O === Ce(OH)4↓+_______H+
(2)已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,逐渐滴入NaOH溶液至溶液呈碱性,在此过程中没有沉淀和气体产生,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
①写出第三步加热该溶液后,有气体生成的反应的离子方程式:_________________;
②待测液中一定含有_______和NO3-离子,一定不含有_________离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称)___________。
③往含等物质的量CO32-和HCO3-的溶液中滴入HCl溶液,下列表示产生的气体在标准状况下的体积与加入的HCl溶液体积关系图正确的是_________。
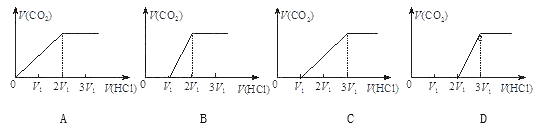
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以完成的实验组合是
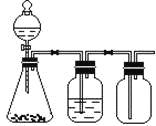
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
【答案】B
【解析】
A. 二氧化锰与氯酸钾制取氧气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项A错误;
B.大理石与盐酸生成二氧化碳气体,属于固液常温型,盐酸有挥发性,挥发的HCl能与碳酸氢钠溶液反应产生二氧化碳气体,且二氧化碳密度比空气的大,能用向上排空气法收集;选项B正确。
C.锌粒与稀硫酸反应生成氢气,属于固液常温型,但氢气密度比空气的小,不能用向下排空气法收集,选项C错误;
D. 二氧化锰与浓盐酸制取氯气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项D错误;
故合理选项是B。
【题型】单选题
【结束】
20
【题目】下列物质中,不可作漂白剂的是( )
A. SO2 B. Ca(ClO)2 C. Na2SiO3 D. NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施可以提高燃料燃烧效率的是( )
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入大大过量的空气
A.①③B.①②③C.①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.9克的镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的氢氧化钠溶液,若要生成沉淀最多,加入这种氢氧化钠溶液的体积是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应 COCl2(g)![]() CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维有助于胃肠蠕动,被人们誉为食物中的“第7营养素”。下列食物中含膳食纤维较多的是
①玉米 ②精制面粉 ③西芹 ④豆腐
A. ①② B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) ![]() N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
/p>
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com