
����Ŀ�������£���100mL0.1mol/LNH4HSO4��Һ�еμ�0.1mol/L��NaOH��Һ��������ҺPH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ������˵����ȷ���ǣ������� 
A.a��b��c��d�ĸ����У�ˮ�ĵ���̶�������d
B.a����Һ�У�c��NH3H2O��+c��H+���Tc��OH����
C.b����Һ�У�c��Na+��+c��NH4+���T2c��SO42����
D.c����Һ�У�c��Na+���Tc��SO42����+c��NH4+��+c��NH3H2O��
���𰸡�C
���������⣺a��b��c��d�ĸ��㣬���ݷ�Ӧ���Ĺ�ϵ��a��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4��b��c��d������Һ������NH3H2O����NH4��2SO4���Դٽ�ˮ�ĵ��룬��NH3H2O����ˮ�ĵ��룮b����Һ�����ԣ�����Һ���У�NH4��2SO4��Na2SO4��NH3H2O���ֳɷ֣�
A��a��b��c��d�ĸ��㣬���ݷ�Ӧ���Ĺ�ϵ��a��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4��b��c��d������Һ������NH3H2O����NH4��2SO4���Դٽ�ˮ�ĵ��룬��NH3H2O����ˮ�ĵ��룮b����Һ�����ԣ�����a��ˮ�ĵ���̶����A����
B��a��ǡ��������H+����Һ��ֻ�У�NH4��2SO4��Na2SO4����Һ�����ԣ�c��H+����c��OH��������B����
C��b����ҺΪ���ԣ���Һ��c��OH����=c��H+������ϵ���غ��֪��c��NH4+��+c��Na+��+c��H+��=2c��SO42����+c��OH��������c��Na+��+c��NH4+��=2c��SO42��������C��ȷ��
D��c���������Ƶ����Ϊ150mL������3[n��N����+n��S��]=4n��Na��������3c��NH4+��+3c��NH3H2O��+3c��SO42����=4c��Na+������D����ѡC��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ԫ��H2A��ˮ�д������µ��룺H2A�TH++HA�� �� HA���TH++A2�� �� �ش��������⣺
��1��Na2A��Һ���ԣ��������������ӷ���ʽ��ʾ����
��2��NaHA��Һ���ԣ������� ��
��3��0.1mol/L��NaHA��Һ��pH=3����Ka��HA����= ��
��4��ij�¶��£���10mL 0.1mol/L NaHA��Һ�м���0.1mol/L KOH��ҺV mL����Һ��ˮ�����ӻ�����Ka=c2��OH��������ʱ��Һ���ԣ�V10 ���������������=����c��K+��/c��Na+��1���������������=��������Һ�е���غ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������п�ͼ����������˵����ȷ���ǣ������� 
A.E2+�������Ա�M2+��������ǿ
B.�ڢ۷�Ӧ��������ϡ������ܿ������ɫ����
C.��Ӧ�ܵ����ӷ���ʽ�ɱ�ʾΪ��E3++3SCN���TE��SCN��3��
D.�ڷ�Ӧ����ֻ��Ũ���ᣬ�ȱ��������ԣ��ֱ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.0 molA ����� 1.5 molB ������3L�������л�ϲ���һ�������������·�Ӧ��2A(g)+B(g) ![]() 2C(g) ��H=��a kJ��mol-1 �� 2s ���� C��Ũ��Ϊ 0.3 mol��L-1�������м�����ȷ����
2C(g) ��H=��a kJ��mol-1 �� 2s ���� C��Ũ��Ϊ 0.3 mol��L-1�������м�����ȷ����
A. ��A��ʾ��ƽ����Ӧ����Ϊ 0.3 mol��(L��s)-1
B. 2sʱ����A��Ũ��Ϊ 0.7mol��L-1
C. ��B��ʾ��ƽ����Ӧ����Ϊ 0.15mol��(L��s)-1
D. 2s �ڣ� A �� B��Ӧ�ų�������Ϊ 0.15a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼֻ��ʾ���뷴Ӧ�йص�һ�ַ�Ӧ������������������ȥ��������A��CΪ��ɫ���壬��д�����пհף� 
��1��������W�Ļ�ѧʽ�������� �� C�ĵ���ʽ �� F����ɫ ��
��2����Ӧ�۵����ӷ���ʽΪ ��
��3����Ӧ�����������ͻ�ԭ�������ʵ���֮��Ϊ ��
��4��д��A��E�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ�������ͼ1�� 
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90�棬����30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺�ò��ᾧ���Ʒ�����ؽᾧ�ò��ᾧ�壮������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%����������Ŀ���ǣ� ��
��2������ˮ�Ľ���������a��b����ʵ����������μӹ��죬�����²�������½�����ԭ���� ��
��3��װ��B�������� �� Ϊʹβ��������գ�C���Լ��� ��
��4���ؽᾧʱ�������ᾧ���Ʒ���ټ����ܽ⡢�ڳ��ȹ��ˡ�����ȴ�ᾧ���ܹ���ϴ�Ӣݸ����ʵ�鲽�裬�õ��ϴ����IJ��ᾧ�壮�ù����пɽ���Ʒ���ܽ�Ƚϴ����������������������ţ�ʱ��ȥ������Ʒ���ܽ�Ƚ�С��������������������ֽ�ϡ�����Һ�С�����
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ�� �� ��ȡ����Ʒ������ˮ��ȫ�ܽ⣬Ȼ����0.02000molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ�����ζ�ǰ��ζ����е�Һ�������ͼ2��������KMnO4��Һ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]�� 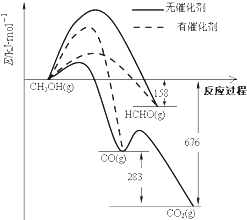
�����д��������£�CH3OH��O2��Ӧ��Ҫ�������CO��CO2����HCHO������2HCHO��g��+O2��g��=2CO��g��+2H2O��g����H= ��
�ڼ״���ȡ��ȩ����Ag������������AgCl�� Ӱ��Ag�����Ļ��ԣ��ð�ˮ�����ܽ��ȥ���е�AgCl��д���÷�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������ں˴Ź��������г�������壬����ԭ�Ӹ���֮��Ϊ3��2�Ļ������ǣ� ��
A.
B.
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ�ϵ����CsHSO4����Ϊ����ʴ���H+��������ṹ����ͼ������ܷ�Ӧ�ɱ�ʾΪ2H2+O2==2H2O�������й�˵����ȷ��������

A. ����ͨ�����·��b������a��
B. b���ϵĵ缫��ӦʽΪ��O2��2H2O��4e-��4OH-
C. ÿת��0.1 mol���ӣ�������1.12 ����H2
D. H+��a��ͨ�����������ʴ��ݵ�b��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com