
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:(提示:SiO2为难溶于盐酸的固体)

请回答下列问题:
(1)固体a的化学式为________。
(2)在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、_________________;Ⅲ中通入足量CO2气体发生反应的离子方程式为________________。
(3)由Ⅲ中得到滤液c的实验操作为_____________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_________________________。
(4)0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合的离子反应方程式为_____________________________________。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和加入的H2SO4的物质的量之比为________。
【答案】SiO2 Al3+ + 4OH-= AlO2-+2H2O AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 过滤 蒸发浓缩、冷却结晶、过滤洗涤 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ 3∶10
【解析】
(1)Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸;
(2)Ⅱ中加过量的烧碱,铝离子和过量碱反应生成偏铝酸钠和水;碳酸的酸性强于偏铝酸,故二氧化碳与偏铝酸钠生成氢氧化铝沉淀;
(3)由Ⅲ中得到滤液c的实验操作为过滤;依据从可溶性溶液中获取固体的实验方法回答;
(4)设NH4Al(SO4)2为2mol,则Ba(OH)2为3mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,恰好需要3mol Ba(OH)2,此时发生2 NH4Al(SO4)2+3 Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓;
(5)设制得的Al2(SO4)3和NH4Al(SO4)2![]() 12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可。
12H2O的物质的量都是1 mol,然后依据铝离子与硫酸根的关系回答即可。
(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2;
故答案为:SiO2;
(2)Al2O3和Fe2O3溶于过量盐酸生成AlCl3、FeCl3,因此在Ⅱ中加过量的烧碱涉及到的反应离子方程式有Fe3+ + 3OH- =Fe(OH)3↓、H+ + OH- =H2O、Al3+ + 4OH-= AlO2-+2H2O;Ⅲ中通入足量CO2气体生成Al(OH)3沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓。
故答案为:Al3+ + 4OH-= AlO2-+2H2O ;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(3)由Ⅲ中得到滤液c的实验操作为过滤;从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤。
故答案为:过滤;蒸发浓缩、冷却结晶、过滤洗涤;
(4)设NH4Al(SO4)2为2mol,则Ba(OH)2为3mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,恰好需要3mol Ba(OH)2,此时发生2 NH4Al(SO4)2+3 Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓,离子方程式为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓。
故答案为:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓。
(5)设制得的Al2(SO4)3和NH4Al(SO4)2![]() 12H2O的物质的量都是1mol,则对应的Al3+共3mol,SO42-共5mol,根据Al3+和SO42-守恒可知加入Al2O3和H2SO4的物质的量之比为
12H2O的物质的量都是1mol,则对应的Al3+共3mol,SO42-共5mol,根据Al3+和SO42-守恒可知加入Al2O3和H2SO4的物质的量之比为![]() :5=3:10。
:5=3:10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关反应的离子方程式书写正确的是
A. Al2O3与过量氨水:Al2O3+2NH3·H2O═2AlO![]() +2NH4++H2O
+2NH4++H2O
B. 钠与水反应:2Na+2H+═2Na++H2↑
C. 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO![]() +H2↑
+H2↑
D. Na2CO3溶液中滴加少量的稀盐酸:H++ CO![]() ═HCO
═HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
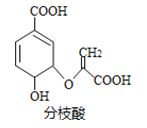
A. 分子中含有5种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:

探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略) 。
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________。
(2)装置 D的作用是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管B 中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管 B 冷却后,取少许其中的固体物质继续进行如下实验:
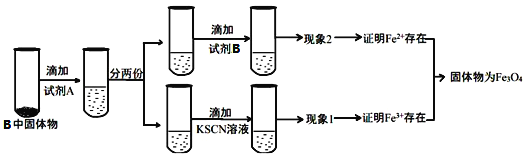
①试剂A是________,现象2为___________________ 。
②若现象1中溶液未变血红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:________________________________________________________________________。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如下:
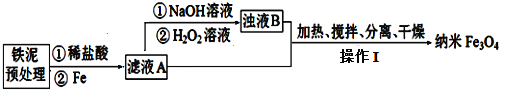
已知:①浊液B中铁元素以FeOOH形式存在;
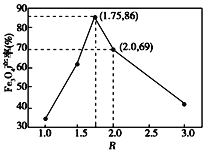
②在操作I中,相同条件下测得Fe3O4的产率与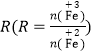 的关系如下图所示。
的关系如下图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是_________。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,保留3位有效数字)
=_________。(填数值,保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的叙述正确的是
A.能在熔化状态下导电的物质,属于电解质
B.在液态不导电的化合物,一定是非电解质
C.固态的硝酸钾不导电是因为没有离子
D.CO2的水溶液能导电,所以H2CO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 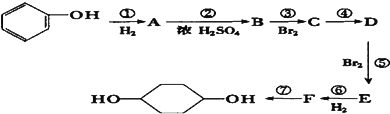
请回答下列问题:
(1)写出 ![]() 的分子式:___
的分子式:___
(2)分别写出B、D的结构简式:B___、D___ .
(3)反应①~⑦中属于消去反应的是___ . (填数字代号)
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件):___ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com