
【题目】现有下列8种有机物:①乙炔②甲苯③溴乙烷④乙醇⑤苯酚⑥乙醛⑦乙酸⑧乙酸乙酯。请回答:
(1)实验室制备①的反应方程式___________________________
(2)能与碳酸氢钠溶液反应产生气体的是______________(填序号,下同)
(3)在一定条件下能与浓硝酸反应生成TNT的是________此反应的化学方程式为_____________________________________
(4)能与银氨溶液发生银镜反应的是______此反应的化学方程式为_________________________________________
(5)在一定条件下能与氢氧化钠水溶液反应的是___________
【答案】CaC+2H-OH→Ca(OH)+CH≡CH↑ ⑦ ②  ⑥ CH3CHO+2Ag(NH3)2OH
⑥ CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O ③⑤⑦⑧
CH3COONH4+2Ag↓+3NH3+H2O ③⑤⑦⑧
【解析】
(1)实验室用碳化钙和水反应制备乙炔;
(2)能够与碳酸氢钠溶液反应,该有机物具有酸性,且酸性大于碳酸,说明含有羧基;
(3)TNT为三硝基甲苯,据此书写方程式;
(4)含有醛基的有机物能够发生银镜反应;
(5)氢氧化钠为碱溶液,能够与氢氧化钠反应的有卤代烃、苯酚、乙酸、酯类等物质;
据此分析解答。
(1)碳化钙和水反应生成氢氧化钙和乙炔,故化学方程式为CaC+2H2O→Ca(OH)+CH≡CH↑,故答案为:CaC+2H2O→Ca(OH)+CH≡CH↑;
(2)能与碳酸氢钠溶液反应产生气体,说明该有机物显示酸性,且酸性大于碳酸,说明分子中含有羧基,满足条件的为乙酸,故答案为:⑦;
(3)在一定条件下能与浓硝酸反应生成TNT,TNT为三硝基甲苯,所以该有机物为甲苯,反应的化学方程式为 ,故答案为:②;
,故答案为:②; ;
;
(4)分子中含有醛基的有机物能够发生银镜反应,8种有机物中,只有乙醛中含有醛基,能够发生银镜反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+H2O+2Ag↓+3NH3,故答案为:⑥;CH3CHO+2Ag(NH3)2OH
CH3COONH4+H2O+2Ag↓+3NH3,故答案为:⑥;CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+H2O+2Ag↓+3NH3;
CH3COONH4+H2O+2Ag↓+3NH3;
(5)苯酚、乙酸能够与氢氧化钠溶液发生中和反应,溴乙烷能够与氢氧化钠溶液发生取代(水解)反应,乙酸乙酯能够与氢氧化钠溶液发生取代(水解)反应,故答案为:③⑤⑦⑧。


科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是

A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:

已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,3-二氢呋喃(![]() )可用于电子化学品和香料中,其合成路线如下:
)可用于电子化学品和香料中,其合成路线如下:
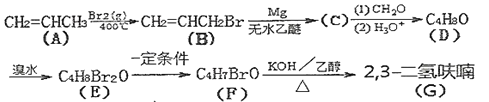
已知:
回答下列问题:
(1)A→B的反应类型为___________。
(2)A的名称为___________;B所含官能团的名称为___________。
(3)写出E的结构简式______________________。
(4)写出F→G的化学方程式______________________。
(5)满足下列条件的F的同分异构体共有___________种。
①含![]() ; ②不含环状结构 ; ③不考虑立体异构。
; ②不含环状结构 ; ③不考虑立体异构。
(6)写出符合下列条件的D的同分异物体的结构简式___________。
①能发生银镜反应。②核磁共振氢谱有三种峰且峰面积之比为6︰1︰1。
(7)写出用1,3-丁二烯为原料制备四氢呋喃(![]() )的合成路线_____________________(无机试剂任选)。
)的合成路线_____________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )

A. pH=7时加入的醋酸溶液的体积大于10 mL
B. C点后继续加入醋酸溶液,水的电离程度减小
C. B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D. Ka(CH3COOH)=5.0×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:
CH3COOC2H5为77.1℃; C2H5OH为78.3℃;
C2H5OC2H5(乙醚)为34.5℃; CH3COOH为118℃。
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸,边加热蒸馏。由上面的实验可得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)制取乙酸乙酯的方程式是___________。
将粗产品经下列步骤精制:
(2)为除去其中的醋酸,可向产品中加入__________(填字母)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(3)再向其中加入饱和氯化钙溶液,振荡,分离,其目的是____________________。
(4)然后再向其中加入无水硫酸铜,振荡,其目的是___________________。最后,将经过上述处理后的液体加入另一干燥的蒸馏瓶内,再蒸馏,弃去低沸点馏分,收集沸点在76℃~78℃之间的馏分即得纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、氯及其化合物有如下转化关系,请按要求填空:

(1)金属钠的密度比水____________,实验室中金属钠通常保存在__________中。一小块金属钠投入水中的反应方程式是_____________________。
(2)Na2O2 是____________色的固体,Na2O2 的重要用途是________________,有关反应的化学方程式为_____________________。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为__________________。
(4)漂白粉的有效成份是________(填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中①~⑦表示元素周期表的部分元素。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
1 | |||||||
2 | ① | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ |
(1)②元素最外层电子数比次外层电子数多______个,该元素的符号是_______;⑦元素的氢化物的电子式为____________________。
(2)由①③④三种元素组成的物质是______________,此物质的水溶液显_____性。
(3)⑥元素的原子半径大于③的理由是____________________________________。
(4)④元素的最高价氧化物对应的水化物的碱性强于⑤元素,用一个化学方程式来证明。________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离:其中试剂1、2、4分别为( )

A.氯化钡溶液、硝酸银溶液、稀硝酸
B.氯化钡溶液、稀硝酸、硝酸银溶液
C.氢氧化钠溶液、硝酸银溶液、稀硝酸
D.硝酸银溶液、硝酸钡溶液、稀硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com