
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离:其中试剂1、2、4分别为( )

A.氯化钡溶液、硝酸银溶液、稀硝酸
B.氯化钡溶液、稀硝酸、硝酸银溶液
C.氢氧化钠溶液、硝酸银溶液、稀硝酸
D.硝酸银溶液、硝酸钡溶液、稀硝酸
科目:高中化学 来源: 题型:
【题目】现有下列8种有机物:①乙炔②甲苯③溴乙烷④乙醇⑤苯酚⑥乙醛⑦乙酸⑧乙酸乙酯。请回答:
(1)实验室制备①的反应方程式___________________________
(2)能与碳酸氢钠溶液反应产生气体的是______________(填序号,下同)
(3)在一定条件下能与浓硝酸反应生成TNT的是________此反应的化学方程式为_____________________________________
(4)能与银氨溶液发生银镜反应的是______此反应的化学方程式为_________________________________________
(5)在一定条件下能与氢氧化钠水溶液反应的是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为_______
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。

(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。

(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4![]() 2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为____。
(2)该反应的平衡常数K=___。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色___(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号)___,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)___。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。____
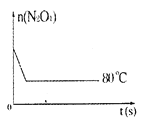
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近报道的一种处理垃圾渗滤液并用其发电的示意图如下。装置工作时,下列说法不正确的是

A. 化学能转变为电能
B. 盐桥中K+向X极移动
C. 电子由X极沿导线流向Y极
D. Y极发生的反应为2NO3-+10e-+12H+=N2+ 6H2O,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某Al2(SO4)3溶液VmL中含有a克Al3+,取出![]() mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
mL溶液稀释成3VmL后,硫酸根离子的物质的量浓度为_________。
(2)在标准状况下,CO和CO2混合气体的质量为36g,体积为22.4L,则其中CO2所占的体积为______,CO所占的质量为______。
(3)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。
①配制该营养液后c(NH4+)=0.016mol/L,溶液中c(K+)=_______________。
②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com