
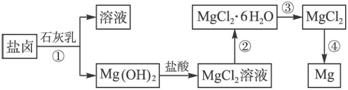
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是__________________
____________________________________________________________________。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有___________溶液的烧杯中,充分搅拌后经___________、___________(填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:

A
其中装置A的作用是_______________________________________________________。
(4)写出过程④中发生反应的化学方程式:______________________________________。
(1)石灰乳原料丰富,成本低
(2)MgCl2(或氯化镁) 过滤 洗涤
(3)制备干燥的HCl气体
(4)MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
解析:海水中提镁是先将海水中的Mg2+转化为Mg(OH)2沉淀,富集,再把Mg(OH)2转化为MgCl2电解。
(1)工业生产中不仅要提取,更要考虑成本,以及原料的丰富程度,所以工业生产中利用石灰乳而不用NaOH将Mg2+沉淀下来。
(2)利用沉淀转化,Ca(OH)2的溶解度大于Mg(OH)2的溶解度,加入MgCl2使Ca(OH)2转化为CaCl2而除去。
(3)MgCl2·6H2O必须在干燥的HCl气流中加热,除去H2O的目的是防止MgCl2的水解。
(4)MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
| FeBr3 |
| FeBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
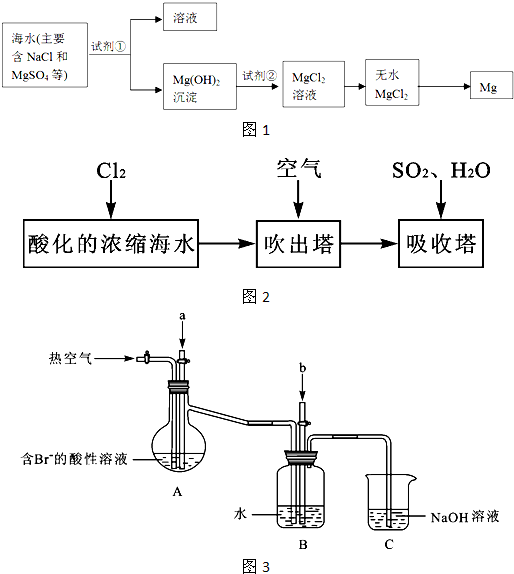
| △ |
| 电解 |
| 2800℃ |
| △ |
| C |
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| 活泼金属 |
| 还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com